小亮在实验室发现一瓶盛有无色溶液的试剂瓶,其标签破损,从残余部分只能看出溶质质量分数为10%,具体是什么物质无法辨认.老师告诉他,这瓶溶液可能是氢氧化钠、氯化钠、氢氧化钙或是碳酸钠中的一种.
(1)小亮查阅氢氧化钙常温下的溶解度为0.18g后,认为该溶液不可能是氢氧化钙,理由是
.
(2)小亮取少量样品于试管中,滴加 试液,试液变红色,该溶液不可能是
(填写化学式),理由是 .
(3)为了确定该溶液的成分,小亮同学继续进行下列实验,请一起参与,并填写下列实验报告.
[设计实验方案]方案甲:选择氯化钙溶液来确定该溶液的成份;方案乙:选择稀盐酸来确定该溶液的成份.
[进行实验]你愿意选择方案 (选填“甲”或“乙”)进行实验.
| 实验步骤 |
实验现象 |
实验结论 |
| 取少量溶液于试管中, |
|
该溶液是碳酸钠溶液, 有关反应得化学方程式为: |
[实验反思](4)有同学认为还可以用一种常见的碱溶液来确定,那么它是 溶液.
(5)小亮经过反思,向同学们提出如下建议,你认为合理的是 (填序号).
A.倾倒液体时应注意保护标签不被腐蚀 B.要有严谨的科学实验的态度 C.无法辨认的药品,直接倒掉,无需保留.
探究影响食盐在水中溶解速率的因素:
小英在做饭时,发现很多因素都能影响食盐在水中溶解的速率。
(1)从你能想到的可能影响食盐在水中溶解速率的因素中,写出其中两项,并预测此因素对食盐溶解速率的影响:
因素①,
你的预测;
因素②,
你的预测。
(2)从你所列因素中选出一个,通过实验验证你的预测。你设计的实验方案是:
小刚从资料上知道,二氧化碳可用做食品的保鲜剂。于是在家里做了如下的探究实验:将煮熟的米饭均分成两份,分别放入A、B两只相同的玻璃杯中,然后向A杯中倒入二氧化碳至满,并将两杯密封好,控制温度在30℃左右。两天后打开密封,A杯中仍可闻到米饭的清香气味,而B杯中散发出难闻的馊味。
(1)可将二氧化碳倒入A杯中,说明二氧化碳的密度比空气。
(2)B杯中米饭变馊,说明细菌在新陈代谢过程中需要(填一种气体)。
(3)实验成功的关键是杯内一定要充满二氧化碳,检验二氧化碳已充满的方法是
如图所示装置可以验证某混合气体(无色无味)是否含有CO2和CO。
请回答下列问题:
(1)A装置中的试剂是(写名称,下同) ,B装置中的试剂是;
(2)证明原混合气体中CO2存在的实验现象是;证明原混合气体中CO存在的实验现象是;
(3)如果没有B装置,对实验结果有何影响?
材料:人类要在月球活居住,首先离不开淡水和氧气,而月球上既没有水又没有空气。科学家发现月球的沙土中含有丰富的含氧钛铁矿,成分为TiO2、Fe2O3的混合物,将这些矿石利用CO来还原提炼单质钛和铁,若用氢气还原,可以得到淡水。将这些矿石通电,还可以从中分离出氧气。
①、月球土壤中存在天然的铁、金、银、等多种金属矿物颗粒。若从铁、金(Au)、银混合金属中回收某些金属,将混合金属放入足量的盐酸中充分反应,然后过滤,剩余的固体中可以回收得到的金属组合是( )
A、Fe、 B、Au、Fe C、Ag、Au D、Fe、Ag
②、据科学家预测,月球的土壤中吸附着百万吨的氦(He-3),其原子核中质子数为2、中子数为1,每百吨氦(He-3)核聚变所释放的能量相当于目前人类一年消耗的能量。下列关于氦(He-3)元素的说法正确的是()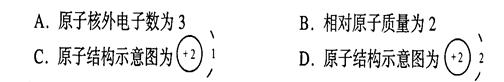
③、“嫦娥一号”发射的火箭推进器中装有液态肼(用A表示)和过氧化氢(H2O2),它们混合时的反应方程式为:2H2O2+A==N2+4H2O ,则肼(A)的化学式为()
A、N2H2 B、N2H4O2 C、NH2D、N2H4
④、从铁生锈条件来分析,月球上铁制品(填“易”或“不易”)生锈,原因是:
。
⑤、现利用CO来还原TiO2、Fe2O3的混合物提炼单质钛和铁,装置如图所示,试回答:
⑴ 写出A中发生反应化学方程式(任意一个)。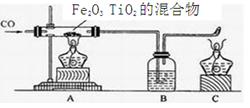
⑵用CO还原钛铁矿,生成钛和铁的混合物,可用简单的物理方法将两种物质分开。
⑶就实验操作顺序的问题两位同学出现了分歧。小月认为先通一段时间CO排空,然后再点燃C和A中的酒精灯,小亮认为这样做不好,他的理由是;
小亮认为先点燃C和A中的酒精灯,然后再通CO,小月又提出反对,她的理由是
老师认为他们的反对意见都有一定道理。请你帮助这两位同学解决他们的困难,你的办法是
已知木炭粉与某红棕色粉末在高温下反应生成二氧化碳和铁。某同学设计了一个实验,证明红棕色粉末中含有氧元素,并测定其中氧元素的质量分数,装置如下图所示。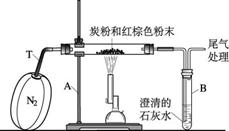
(1)实验前,首先要进行的操作是________________________________________;
(2)实验中,盛放澄清石灰水的大试管中出现的现象是_________________________;
(3)实验中通入纯净而干燥的氮气,其目的是_________________________________;
(4)尾气中可能含有的一种有毒气体是;
(5)如果3.2 g该红棕色粉末与碳充分反应,测得澄清石灰水增重1.32 g,则该红棕色粉末中氧元素的质量分数为写出计算过程如下: