请回答下列问题:
(1)若分别将pH=2的盐酸和醋酸稀释100倍,则稀释后溶液的pH:盐酸 醋酸(填“>”、“=”或“<”)。
(2)将100mL 0.1mol•L-1的CH3COOH溶液与50mL 0.2mol•L-1的NaOH溶液混合,所得溶液呈 性,原因是 (用离子方程式表示)。
(3)0.1mol·mol-1的氨水溶液中存在电离平衡NH3+H2O  NH3·H2O
NH3·H2O NH4++OH-,在此平衡体系中改变条件(见下表),请完成表中空格:
NH4++OH-,在此平衡体系中改变条件(见下表),请完成表中空格:
| |
条件的变化 |
通氨气 |
加水 |
加NH4Cl(s) |
| ① |
电离平衡移动的方向 |
|
|
|
| ② |
c(OH-)的变化 |
|
|
|
[第①行填“向左”、“向右”或“不移动” 第②行填“增大”、“减小”或“不变”]
(14分)I.下表为元素周期表的一部分:(用元素符号或化学式填空)
| 族 周期 |
||||||||
| ① |
||||||||
| ② |
||||||||
| ③ |
④ |
⑤ |
⑥ |
|||||
(1)写出元素④在周期表中的位置______________。
(2)②、③、⑤的原子半径由大到小的顺序为_________________________。
(3)④、⑤、⑥的气态氢化物的稳定性由强到弱的顺序是_________________________。
(4)①、②、③、⑥中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
II.由上述部分元素组成的物质间,在一定条件下,可以发生下图所示的变化,其中A是一种淡黄色固体。请回答: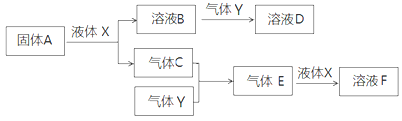
(1)写出固体A与液体X反应的离子方程式 。
(2)气体Y是一种大气污染物,直接排放会形成酸雨。可用溶液B吸收,当B与Y物质的量之比为1:1且恰好完全反应时,所得溶液D的溶质为 (填化学式)。
(3)写出气体C与气体Y反应的化学方程式 。
【原创】(13分)根据下列有机物的结构完成问题
(1)可鉴别风信子醛和冬青油的试剂是 。
(2)下列关于冬青油和突厥酮的说法中正确的是 (填序号)。
| A.都属于芳香族化合物 | B.都能使酸性高锰酸钾溶液褪色 |
| C.突厥酮的分子式为C13H20O | D.都能发生水解反应 |
(3)突厥酮与溴水反应的化学方程式为 。
(4)写出符合下列条件的风信子醛的同分异构体的结构简式______;(任写一种)
a.含有苯环,苯环上有两个支链
b.与新制氢氧化铜浑浊液共热无砖红色沉淀芳香烃
由Cu、N、B等元素组成的新型材料有着广泛用途。
(1)基态Cu+ 的核外电子排布式为 。在高温下CuO能分解生成Cu2O,试从原子结构角度解释其原因: 。
(2)立方氮化硼是一种新型的超硬、耐磨、耐高温的结构材料,它属于 晶体。
(3)化合物A (H3BNH3) 是一种潜在的储氢材料,它可由六元环状化合物 (HB=NH)3通过
3CH4+2(HB=NH)3 + 6H2O →3CO2 + 6H3BNH3 制得。
①与上述化学方程式有关的叙述不正确的是 。(填标号)
| A.反应前后碳原子的轨道杂化类型不变 |
| B.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形 |
| C.第一电离能:N>O>C>B |
| D.化合物A中存在配位键 |
②1个(HB=NH)3分子中有 个σ键。
(4)在硼酸盐中,阴离子有链状、环状等多种结构形式。图(a)是一种链状结构的多硼酸根,则多硼酸根离子符号为 。图(b)是硼砂晶体中阴离子的环状结构,其中硼原子采取的杂化类型为 。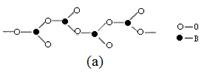
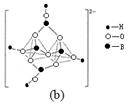
如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:
(1)甲烷燃料电池负极反应式是 ;
(2)石墨(C)极的电极反应式为 ;
(3)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁极上生成的气体体积为________L ,丙装置中阴极析出铜的质量为________g ;
(4)某同学利用甲烷燃料电池设计电解法制取漂白液或Fe(OH)2的实验装置(如图所示)。
若用于制漂白液,a为电池的________极,电解质溶液最好用________;若用于制Fe(OH)2,使用硫酸钠作电解质溶液,阳极选用________作电极。
短周期元素X、Y、Z、W在周期表中的位置如图所示,其中W的氧化物是酸雨形成的主要物质。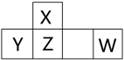
(1)写出W的原子结构示意图: 。
(2)将足量X的最高价氧化物通入含Y元素的阴离子溶液中。反应的离子方程式为 。
(3)已知:①X(s) + O2(g) =XO2(g)ΔH=-393.5 kJ·mol-1
②H2(g) + 1/2 O2(g) =H2O(g)ΔH=-242.0 kJ·mol-1
③XH4(g) + 2O2(g) =XO2(g) + 2H2O(g) ΔH=-802.0 kJ·mol-1
则XH4气体分解成氢气和X固体的热化学方程式为 。
(4)ZO是由单质X和ZO2反应制取单质Z的中间产物。隔绝空气时,ZO与NaOH溶液反应(产物含有一种固体单质和一种钠盐)的化学方程式为_______________。
(5)利用原电池原理,可用W的一种氧化物、O2和H2O来制备W的最高价氧化物对应水化物。写出该电池负极反应式___________。
(6)将W的气态氢化物通入一定量的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,生成气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发)。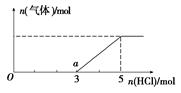
①O点溶液中所含溶质的化学式为____________。
②a点溶液中,c(Na+): c(Cl-)=_______________。