Ⅰ.A、B、C、D、E五种有机物分子中碳原子数相同,A为气态,标准状况下的密度为1.16g·L-1;B或D跟溴化氢反应都生成C;D在浓硫酸存在下发生消去反应生成B,一定条件下被催化氧化可生成E。
(1)A、B、C的结构简式分别是________、 、
(2)写出下列反应的方程式D→E___________________________________________________________。
Ⅱ.有机物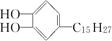 是我国特产漆的主要成分。能够跟1 mol该化合物起反应的Br2或H2的最大用量分别是 mol 、 mol
是我国特产漆的主要成分。能够跟1 mol该化合物起反应的Br2或H2的最大用量分别是 mol 、 mol
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中的悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。
某科研小组用电浮选凝聚法处理污水,设计装置示意图如下。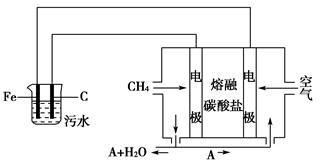
请回答下列问题。
(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的________。
a.H2SO4 b.BaSO4 c.Na2SO4
d.NaOH e.CH3CH2OH
(2)电解池阳极的电极反应分别是:①__________;②4OH--4e-=2H2O+O2↑。
(3)电极反应①和②的生成物反应得到Fe(OH)3沉淀的离子方程式是________________。
(4)该熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极。已知负极的电极反应是CH4+4CO32—-8e-=5CO2+2H2O。
①正极的电极反应是____________________________________________。
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见装置示意图)。A物质的化学式是____________________________________________________________。
(5)实验过程中,若在阴极产生了44.8 L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况)________________________________________________L。
某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的开关K时,观察到电流计的指针发生了偏转。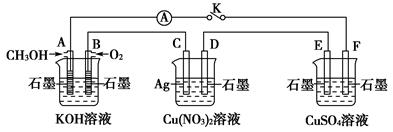
甲池 乙池 丙池
请回答下列问题:
(1)甲、乙、丙三池中为原电池的是________(填“甲池”“乙池”或“丙池”)。
(2)丙池中F电极为________(填“正极”“负极”“阴极”或“阳极”),该池的总反应式为__________________________________________________。
(3)当乙池中C电极质量减轻10.8 g时,甲池中B电极理论上消耗O2的体积为________mL(标准状况)。
(4)一段时间后,断开开关K。下列物质能使丙池恢复到反应前浓度的是________(填选项字母)。
| A.Cu | B.CuO | C.CuCO3 | D.Cu2(OH)2CO3 |
人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如图。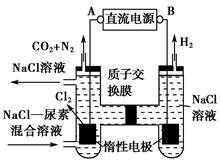
(1)电源的负极为________(填“A”或“B”)。
(2)阳极室中发生的反应依次为___________________________________、
___________________________________________________________。
(3)电解结束后,阴极室溶液的pH与电解前相比将________;若两极共收集到气体13.44 L(标准状况),则除去的尿素为________g(忽略气体的溶解)。
该同学利用制得的CuSO4溶液及如图所示装置,进行以下实验探究。
图一 图二
(1)图一是根据反应Zn+CuSO4=Cu+ZnSO4设计成的锌铜原电池。Cu极的电极反应式是_____________________________________________________,
盐桥中是含有琼胶的KCl饱和溶液,电池工作时K+向________(填“甲”或“乙”)池移动。
(2)图二中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则b处通入的是________(填“CH4”或“O2”),a处电极上发生的电极反应是_____________________________________________;
当铜电极的质量减轻3.2 g时,消耗的CH4在标准状况下的体积为________L。
探究小组用滴定法测定CuSO4·5H2O(Mr=250)含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol ·L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:
Cu2++H2Y2-=CuY2-+2H+
(1)写出计算CuSO4·5H2O质量分数的表达式w=_______________;
(2)下列操作会导致CuSO4·5H2O含量的测定结果偏高的是________。
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子