工业上用某矿渣(主要成分是Cu2O,少量杂质是Al2O3、Fe2O3和SiO2)提取铜的操作流程如下:
已知:Cu2O+2H+==Cu+Cu2++H2O
| 沉淀物 |
 |
 |
 |
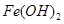 |
| 开始沉淀pH |
5.4 |
4.0 |
2.2 |
5.8 |
| 沉淀完成pH |
6.7 |
5.2 |
3.2 |
8.8 |
(1)固体混合物A中的成分是 (填化学式)。
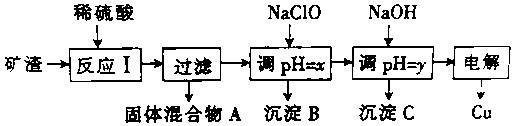
(2)反应I完成后,铁元素的存在形式为 (填离子符号)。
(3)y的数值范围是 。
(4)若电解法获得Cu 64.0g,则原矿渣中Cu2O的质量是 。
a、144.0g b、大于144.0g c、小于144.0g
(5)下列关于用NaClO调节溶液pH的说法正确的是 。
a、加入NaClO可使溶液的pH降低
b、NaClO能调节pH的主要原因是由于发生反应: 消耗H+,从而达到调节pH的目的
消耗H+,从而达到调节pH的目的
c、NaClO能调节pH的主要原因是由于NaClO水解: OH—消耗H+,从而达到调节pH的目的。
OH—消耗H+,从而达到调节pH的目的。
(6)用NaClO调pH,生成沉淀B的同时生成一种具有漂白作用的物质,且该物质与还原产物的物质的量之比为4:1,该反应的离子方程式为 。
把除去氧化膜的镁条投入到盛有稀盐酸的试管中,产生氢气的速率变化情况如右图所示
图中t1~t2速率变化的主要原因是________,t2~t3速率变化的主要原因是。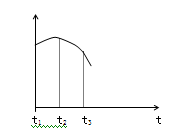
卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)基态溴原子的价电子排布式为_______________。
(2)卤素互化物如IBr、ICl等与卤素单质结构相似、性质相近。则Cl2、IBr、ICl的沸点由高到低的顺序为_____________。
(3)气态氟化氢中存在二聚分子(HF)2,这是由于___________________________。
(4)I3+属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为_____________________,中心原子杂化类型为________________。
(5)①HClO4、②HIO4、③H5IO6[可写成(HO)5IO]的酸性由强到弱的顺序为____________(填序号)。
(6)卤化物RbICl2在加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,A的化学式为______________________。
硫酸盐主要来自地层矿物质,多以硫酸钙、硫酸镁的形态存在。
(1)已知:①Na2SO4(s)=Na2S(s)+2O2(g)ΔH1="+1011.0" kJ·mol-1
②C(s)+O2(g)=CO2(g)ΔH2=-393.5 kJ·mol-1
③2C(s)+O2(g)=2CO(g)ΔH3=-221.0 kJ·mol-1
则反应④Na2SO4(s)+4C(s)=Na2S(s)+4CO(g)ΔH4=________kJ·mol-1;工业上制备Na2S时往往还要加入过量的炭,同时还要通入空气,目的有两个,其一是使硫酸钠得到充分还原(或提高Na2S产量),其二是_____________________________________________。
(2)智能材料是当今材料研究的重要方向之一,纳米Fe3O4由于具有高的比表面、高的比饱和磁化强度和顺磁为零的超顺磁性而被广泛地用作磁流体的磁性粒子。水热法制备Fe3O4纳米颗粒的反应是:
3Fe2+ + 2S2O32- + O2 + xOH-=Fe3O4+S4O62-+2H2O
请回答下列问题:
①水热法所制得的水基磁流体超过30天都未出现分层和混浊现象,因为该分散系是________。
②上述反应方程式x=___________________。
③该反应中1molFe2+被氧化时,被Fe2+还原的O2的物质的量为_____。
(3)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是____________。
②由MgO可制成“镁—次氯酸盐”燃料电池,其装置示意图如上图,该电池反应的化学方程式为_____________________________________________________。
某矿样含有大量的CuS、少量铁的氧化物及少量其它不溶于酸的杂质。某化学课外小组设计以下流程,取该矿样为原料生产CuC12·2H2O 晶体。
已知:常温下,金属离子开始沉淀和沉淀完全时的pH 见下表。
| 金属离子 |
氢氧化物开始沉淀的pH |
氢氧化物沉淀完全的pH |
| Fe2+ |
7.0 |
9.0 |
| Fe3+ |
1.9 |
3.2 |
| Cu2+ |
4.7 |
6.7 |
回答下列问题:
(l)步骤①的焙烧过程中需要通入氧气。在实验室中,可使用常见化学物质利用上图所示装置制取氧气,试写出熟悉的符合上述条件的两个化学方程式:______________________、______________________。
(2)焙烧产生的尾气中含有的一种气体是形成酸雨的污染物,若将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式:____________________、__________________。
(3)步骤②酸浸过程中,需要用到3 mol · L-1的盐酸100 mL,配制该盐酸溶液时,除了用到烧杯、玻璃棒、胶头滴管外,还需要的仪器有_______________________________________。
(4)步骤④加入物质X的目的是_________________________________________,物质X 可以选用下列物质中的______________________。
(A)氢氧化钠(B)稀盐酸(C)氨水(D)氧化铜
(5)当溶液中金属离子浓度低于1×10-5 mol · L-1时,认为该金属离子沉淀完全,则Ksp[Fe(OH)2]=_____。
平衡指的是两个相反方向的变化最后所处的运动状态;在平衡时,两种变化仍在继续进行,但是它们的速率相等;根据变化的性质可分为物理平衡和化学平衡,中学阶段涉及的平衡有气体可逆反应的平衡、酸碱电离平衡、水解平衡及沉淀-溶解平衡等等。
(1)现有容积为1 L的恒温恒容密闭容器,向其中加入2 mol A气体和2 mol B气体后发生如下反应:A(g)+B(g) C(g) △H=" -" a kJ·mol-1,20s后,反应达到平衡状态,生成1 mol C气体,放出热量Q1kJ。回答下列问题。
C(g) △H=" -" a kJ·mol-1,20s后,反应达到平衡状态,生成1 mol C气体,放出热量Q1kJ。回答下列问题。
①计算20s内B气体的平均化学反应速率为___________,写出该反应的平衡常数表达式___________。
②保持容器温度和容积不变,若改为向其中加入1molC气体,反应达到平衡时,吸收热量Q2kJ,则Q1 与Q2的相互关系正确的是____________(填字母)。
(A)Q1 + Q2 = a(B) Q1 + 2Q2 < 2a(C)Q1 + 2Q2 > 2a(D)Q1 + Q2 < a
③在原平衡基础上,保持容器温度和容积不变,向容器中再通入bmolA气体(b>0)时,v(正)_____v(逆)(填“>”、“<”或“=”),重新达平衡后,C气体的平衡体积分数 (C) =
(C) =  ,则b = ____________。
,则b = ____________。
(2)常温下,将VmL、0.1000mol·L-1氢氧化钠溶液逐滴加入到20.00mL、0.1000mol·L-1醋酸溶液中,充分反应。回答下列问题。(忽略溶液体积的变化)
①如果溶液pH=7,此时V的取值_____20.00(填“>”、“<”或“=”),而溶液中c(Na+)、c(CH3COO-)、c(H+)、c(OH-)的大小关系为_____________________________________________。
②如果V=40.00,则此时溶液中c(OH-) -c(H+) - c(CH3COOH)= ___________________mol·L-1。