Ⅰ.实验室需配制500mL 0.2mol/L NaCl溶液
(1)本实验用到的仪器已有药匙、烧杯、量筒、托盘天平(砝码、镊子)、玻璃棒、胶头滴管,还缺少的玻璃仪器是 。
(2)配制时,需称取NaCl的质量是 g
(3)在配制过程中,其他操作都正确的情况下,下列操作会导致所配制的溶液浓度偏高的是 。(选填序号)
①没有洗涤烧杯和玻璃棒
②加蒸馏水时,不慎超过了刻度,取出少量水使液面恰好到刻度线
③容量瓶不干燥,含有少量蒸馏水
④定容时仰视标线
⑤定容时俯视标线
Ⅱ.某催化剂为铁的氧化物,一化学兴趣小组在实验室里对该催化剂中铁元素的价态进行探究:查阅有关资料得知Fe2+能被酸性KMnO4溶液氧化而使酸性KMnO4溶液褪色;HNO3具有强氧化性。请完成对铁元素价态的探究:
(1)提出合理假设。
假设1:催化剂中铁元素为+3价;
假设2: ;
假设3:催化剂中铁元素既有+3价又有+2价
(2)设计实验方案。
(3)根据(2)的实验方案进行实验:
步骤1:取一定量的稀硫酸于试管中,加热煮沸数分钟,目的是 ;
步骤2:取少量样品于试管中,加入处理过的硫酸并加热,得到A溶液;
步骤3:取A溶液于试管,滴加KSCN溶液,振荡,若不出现血红色,则假设 成立;若出现血红色,则假设1或3成立;
步骤4:为了进一步确定步骤3中是假设1还是假设3成立:另取A溶液于试管,加入KMnO4溶液,振荡,若出现 现象,则假设1成立;反之,则假设3成立。
(4)反思
某同学将步骤2中的稀硫酸改成稀硝酸得到了A溶液,向A溶液中滴加KSCN溶液后出现血红色,由此得出该催化剂中铁元素为+3价的结论。请判断该结论是否合理
(填“合理”或“不合理”)。
下图是工业生产硝酸的流程。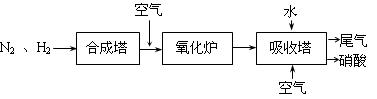
合成塔中内置铁触媒,氧化炉中内置Pt-Rh合金网。请回答下列问题:
⑴ 1909年化学家哈伯在实验室首次合成了氨。2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意如下:
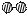 、
、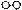 、
、 分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是。
分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是。
⑵ 合成氨反应的化学方程式为N2(g)+3H2(g) 2NH3(g),写出该反应的化学平衡常数表达式K=
2NH3(g),写出该反应的化学平衡常数表达式K=
。在一定温度和压强下,将H2和N2按3∶1(体积比)混合后进入合成塔,反应达到平衡时,平衡混合气中NH3的体积分数为15%,此时H2的转化率为。
⑶ 已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1266.8 kJ/mol
N2(g)+O2(g)=2NO(g)△H=+180.5 kJ/mol
氨催化氧化的热化学方程式为。
⑷ 吸收塔中通入空气的目的是。
下图是中学化学中常见物质之间的相互转化关系。其中C可用于漂白,空气中M含量增加会导致温室效应。反应③常用于实验室制取气体B。
请回答下列问题:
⑴ C的分子式为 ,J的电子式为 。
⑵ 写出反应①的离子方程式 。
⑶ 写出反应②的化学方程式 。
⑷C、M有相似的化学性质,但也有区别,如C有漂白性、M五漂白性。C、M具有其他不同化学性质的原因是 。
某有机化合物D,其相对分子质量为166,取8.3g该物质完全燃烧得到CO2与H2O的物质的量之比是9:5。回答下列问题:
(1)D的分子式为:;
(2)已知其分子结构中含有一个苯环,苯环的两个邻位有取代基。进一步实验可知:
①D能与碳酸氢钠溶液反应生成无色无味气体。②8.3gD物质与足量金属钠反应可生成氢气1.12L(标准状况)。③D不能与FeCl3溶液发生显色反应。④D不能发生消去反应。请写出符合上述条件的D的所有同分异构体的结构简式:
(3)已知D的一种同分异体有以下转化关系。取C在NaOH水溶液中反应后的混合液,加入足量硝酸酸化后,再加入硝酸银溶液,出现白色沉淀。E分子中有两个六元环结构。
①A的结构简式为;
②上述转化过程中涉及到的反应类型有(填选项);
| A.氧化反应 | B.加成反应 | C.取代反应 | D.聚合反应 |
③写出由A→B的化学方程式:;
写出由D→E的化学方程式:。
某研究性学习小组从网上查到绿矾(FeSO4·7H2O)受热分解的方程式为:
2FeSO4·7H2O Fe2O3+SO3↑SO3↑+14H2O↑,就设计了如下实验装置来验证绿矾受热分解是否发生上述反应。
Fe2O3+SO3↑SO3↑+14H2O↑,就设计了如下实验装置来验证绿矾受热分解是否发生上述反应。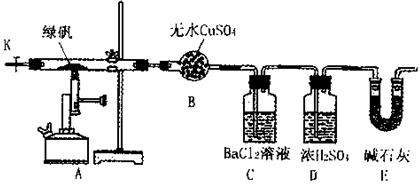
主要实验步骤如下:
①组装仪器并检查装置的气密性;
②称量绿矾样口及U型干燥管E的质量,将称量后的绿矾置于硬质玻璃管内;
③关闭活塞K,加强热使绿矾完全分解;
④打开活塞K,缓缓鼓入一定量的氮气;
⑤再次称量干燥管E的质量;
⑥重复④⑤的操作,直到干燥管E的质量基本不变为止;
⑦称量洗气瓶C中所得沉淀的质量。
试回答:
(1)洗气瓶D中浓H2SO4的作用为:;
(2)步骤⑦从溶液中获取生成沉淀质量的具体操作为:;
(3)实验小组的报告如下,请补充完整:
| 实验记录 |
分析或计算结果 |
|
| 现象 |
硬质管内绿色变为红棕色; |
生成物有 |
| 干燥管B中晶体白色变蓝色。 |
生成物有H2O |
|
| 数据 |
称取绿矾样品16.68g; |
反应的绿矾0.06mol |
| 干燥管E最后增重2.24g; |
生成SO2mol |
|
| C中生成白色沉淀的质量为4.66g; |
生成DO3 0.02mol |
(4)该实验所得到的数据与所样到的化学方程式中的定量关系不相符合,请分析可能的原因。
(5)为达到“验证绿矾受热分解是否发生上述反应”的目的,该实验的设计有多处不妥,请提出改进建议(两条即可)
现有六种元素A、B、C、D、E、F均为周期表中前20号元素,且原子序数依次增大。已知A和B是形成化合物种类最多的两种元素;B元素和C元素通常形成电子数为14或22的化合物。D元素的原子半径是短周期主族元素中最大的;E元素在地壳中含量居第二位;F是组成人体骨骼的牙齿的主要元素。
请回答以下问题:
(1)请画出F的离子结构示意图:;由C、A两种元素形成的18电子化合物的电子式为;
(2)工业上制取E单质的化学方程式为:;
(3)由以上六种元素两两组合所形成的化合物中,既含有离子键又含有非极性共价键的常见化合物有和(填化学式);它们都能与水反应生成气体,写出其中一个属于非氧化化还原反应的化学方程式;
(4)由A、B两种元素形成的正四面体分子是一种常见的气体燃料。通常状况下1g该物质完全燃烧生成液态水时所释放的能量为51.25kg/mol,请写出表示其燃烧热的热化学方程式:;
(5)下图是中学常见的几种晶体结构。有关说法正确的是(填选项)。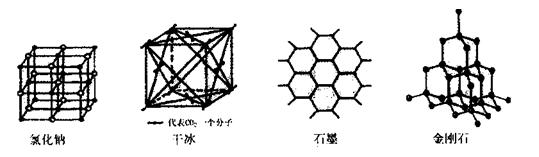
A.氯化钠的晶体结构中,和钠离子最近且等距离的氯离子组成了一个正八面体
B.干冰晶体是CO2分子通过范德华力结合形成的
C.石墨晶体中碳原子数与所形成的共从键数目之比为2:3
D.金刚石晶体是由五个碳原子形成的正四面体分子构成的