(8分)最近雾霾天气又开始肆虐我国大部分地区。其中SO2是造成空气污染的主要原因,利用钠碱循环法可除去SO2。
(1)钠碱循环法中,吸收液为Na2SO3溶液,该吸收反应的离子方程式是
(2)已知H2SO3的电离常数为 K1=1.54×10-2 , K2=1.02×10-7, H2CO3的电离常数为 K1=4.30×10-7, K2= 5.60×10-11,则下列微粒可以共存的是_____________。
A.CO32- HSO3- B.HCO3- HSO3-
C.SO32- HCO3- D.H2SO3 HCO3-
(3)吸收液吸收SO2的过程中,pH随n(SO3²﹣):n(HSO3﹣)变化关系如下表:
| n(SO3²﹣):n(HSO3﹣) |
91 :9 |
1 :1 |
1 :91 |
| pH |
8.2 |
7.2 |
6.2 |
①上表判断NaHSO3溶液显 性,从原理的角度解释原因
②在NaHSO3溶液中离子浓度关系不正确的是(选填字母):
A.(Na+)= 2c(SO32-)+ c(HSO3-),
B.(Na+)> c(HSO3-)> c(H+)> c(SO32-)> c(OH-),
C.(H2SO3)+ c(H+)= c(SO32-)+ (OH-),
D.(Na+)+ c(H+)=" 2" c(SO32-)+ c(HSO3-)+ c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生 。再生示意图如下:

① 吸收液再生过程中的总反应方程式是 。
② 当电极上有1mol电子转移时阴极产物为 克.
(6分)NaOH的摩尔质量为_________,1.204×1023个NaOH分子物质的量为__________,需要____________g HCl,能与这些NaOH完全反应。
(6分)等物质的量的CO和CO2所含分子数之比为_____________,所含氧原子数之比为______,
质量之比为_____________。
(4分)下列物质中:①Mg ②液态氯化氢 ③干冰 ④水 ⑤BaSO4
⑥熔融氢氧化钠 ⑦稀硫酸 ⑧醋酸 ⑨乙醇 ⑩固体氯化钠(用序号作答)。
其中:(1)属于电解质的是________;(2)属于非电解质的是________。
氨在国民经济中占有重要地位。
(1)已知合成氨反应:N2(g)+3H2(g) 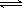 2NH3(g) ΔH < 0;在某密闭容器中充入合成氨的原料气(N2、H2),一定时间后达到平衡。为提高氨合成反应速率,同时使平衡向氨合成方向移动。下列措施可行的是(填写编号)
2NH3(g) ΔH < 0;在某密闭容器中充入合成氨的原料气(N2、H2),一定时间后达到平衡。为提高氨合成反应速率,同时使平衡向氨合成方向移动。下列措施可行的是(填写编号)
① 升高温度; ② 缩小容器体积(加压); ③ 选择高效催化剂;④ 在恒容条件下,再充入合成氨的原料气(N2、H2);⑤在恒容条件下,再充入原平衡的混合气;⑥在恒容条件下,分离出氨气。
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
| T / ℃ |
165 |
175 |
185 |
195 |
| K |
111.9 |
74.1 |
50.6 |
34.8 |
ΔH(填“>”、“<”或“=”)0。
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)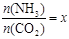 ,下图是氨碳比(x)与CO2平衡转化率(α%)的关系。α随着x增大而增大的原因是。
,下图是氨碳比(x)与CO2平衡转化率(α%)的关系。α随着x增大而增大的原因是。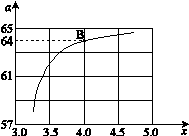
③上图中的B点处,NH3的平衡转化率为。
(1)在一定条件下,容积为 10L密闭容器中发生反应:CH4(g)+H2O(g)  CO(g)+3H2(g);ΔH>0,将1.0 mol CH4和2.0 mol H2O(g)通入该密闭容器10 min时有0.1 mol CO生成,则10 min内该反应的平均速率υ(H2) 。
CO(g)+3H2(g);ΔH>0,将1.0 mol CH4和2.0 mol H2O(g)通入该密闭容器10 min时有0.1 mol CO生成,则10 min内该反应的平均速率υ(H2) 。
(2)在压强为0.1 MPa条件下,容积为V L某密闭容器中a mol CO与2a mol H2在催化剂作用下反应生成甲醇: CO(g)+2H2(g)  CH3OH(g) 平衡时CO的转化率与温度、压强的关系如图。
CH3OH(g) 平衡时CO的转化率与温度、压强的关系如图。
①该反应的△H0 (填“<”、“>”或“=”)。
②100℃时该反应的平衡常数K=(用含a、V的代数式表示)。
③在温度容积不变的情况下,向该密闭容器再增加a mol CO与 2a mol H2,达到新平衡时,CO的转化率(填“增大”、“减小”或“不变”)。平衡常数 (填“增大”、“减小”或“不变”)
④在某温度下,向一个容积不变的密闭容器中通入2.5mol CO和7.5mol H2反应生成CH3OH(g),达到平衡时CO的转化率为80%,此时容器内的压强为开始时的倍。