金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下,回答下列问题: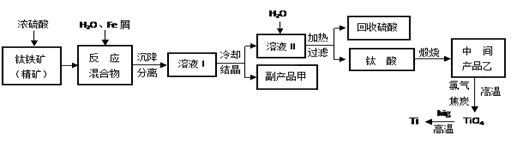
(1)钛铁矿和浓硫酸反应的产物之一是TiOSO4,反应中无气体生成。副产品甲俗称“绿矾”其化学式是________________。
(2)上述生产流程中加入Fe屑的目的是 (用离子方程式表示),检验副产品甲是否变质的实验方法是 。
(3)上述生产流程中所得到的金属钛中混有少量杂质,可加入 溶解后除去。
(4)溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
| 氢氧化物 |
Fe(OH)2 |
TiO(OH)2 |
Mg(OH)2 |
| Ksp |
8.0×10-16 |
1.0×10-29 |
1.8×10-11 |
①常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol/L,当pH等于_________时,Mg(OH)2开始沉淀。
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,写出该反应的离子方程式:__________________________________________________________________
(5)Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应控制的反应条件是__________________________
(6)在800--1000℃时电解TiO2也可制得海绵钛,装置如图所示。图中b是电源的______极,阴极的电极反应式________________。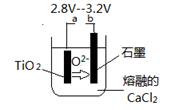
Zn—MnO2干电池应用广泛,其电解质溶液是ZnCl2—NH4Cl混合溶液。
( 1)该电池的负极材料是。电池工作时,电子流向(填“正极”或“负极”)。
1)该电池的负极材料是。电池工作时,电子流向(填“正极”或“负极”)。
(2)若ZnCl2—NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是。欲除去Cu2+,最好选用下列试剂中的(填代号)。
a.NaOH b.Zn c.Fe d.NH3·H2O
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是。若电解电路中通过2mol电子,MnO2的理论产量为克。
下图A为直流电源,B为渗透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B 上的 C 点显红色,请填空: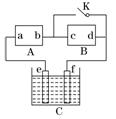
(1)电源A的a为极。
(2)滤纸B上发生的总反应方程式为:
。
(3)欲在电镀槽中实现铁上镀铜,接通K点,使c、d两点短路,则电极e的电极材料为,f极上发生的反应为:。
中学化学实验中,淡黄色的pH试纸常用于测定溶液的酸碱性.在25℃时,若溶液的pH=7,试纸不变色;若pH<7,试纸变红色;若pH>7,试纸变蓝色.而要精确测定溶液的pH,需用pH计.pH计主要通过测定溶液中H+浓度来测定溶液的pH.
(1)已知水中存在如下平衡:
H2O+H2O H3O++OH- ΔH>0
H3O++OH- ΔH>0
现欲使平衡向右移动,且所得溶液呈酸性,选择的方法是(填字母).
| A.向水中加入NaHSO4 |
| B.向水中加入Na2CO3 |
| C.加热水至100℃[其中c(H+)=1×10-6 mol/L] |
| D.在水中加入(NH4)2SO4 |
(2)现欲测定100℃沸水的pH及酸碱性,若用pH试纸测定,则试纸显 色,溶液呈性(填“酸”、“碱”或“中”);若用pH计测定,则pH7(填“>”、“<”或“=”),溶液呈_性(填“酸”、“碱”或“中”).
某无色溶液X,由Na+、Ag+、Ba2+、Al3+、AlO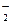 、MnO
、MnO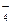 、CO
、CO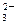 、SO
、SO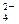 中的若干种离子组成,取溶液进行如下连续实验:
中的若干种离子组成,取溶液进行如下连续实验: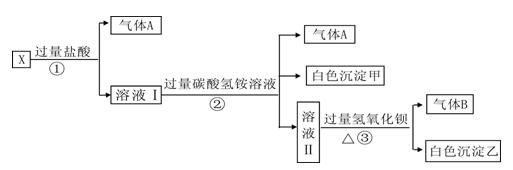
(1)白色沉淀甲是。
(2)X溶液中一定存在的离子是。
(3)白色沉淀乙中一定有:,可能有证明其是否存在的方法是。
(4)若将过量的气体A与适量的气体B通入水中,写出反应的离子方程式
不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气。为了验证这一事实,某同学拟 用下图装置进行实验(实验时压强为10lkPa,温度为0℃)。
用下图装置进行实验(实验时压强为10lkPa,温度为0℃)。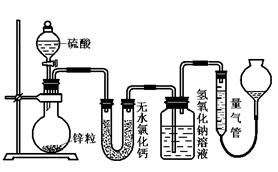
(1)若在烧瓶中放入1.30g锌粒,与c mol/L H2SO4反应,为保证实验结论的可靠,量气管的适宜规格是。
A.200 mL B.400 mL C.500mL
(2)若1.30g锌粒完全溶解,氢氧化钠洗气瓶增重l.28g ,则圆底烧瓶中发生反应的化学方
程式为:________________________________。
(3)若烧瓶中投入a g锌且完全反应,氢氧化钠洗气瓶增重b g.量气瓶中收集到Vml气体,则有:ag/65g·mol-1=bg/64g·mol-1+V ml/ 22400 ml·mol-1,依据的原理是。
(4)若在烧瓶中投入d g锌,加入一定量的c mol/L 浓硫酸V L,充分反应后锌有剩余,测得氢氧化钠洗气瓶增重mg,则整个实验过程产生的气体中,n(H2)/n(SO2)= (用含字母的代数式表示)。若撤走盛有无水氯化钙的U型管,
n(H2)/n(SO2)的数值将(填偏大、偏小或无影响)
(5) 反应结束后,为了准确地测量气体体积,量气管在读数时应注意:
①
②
③