(14分)现有A、B、C三种气体,A是密度最小的气体,B在通常情况下呈黄绿色,纯净的A可以在B中安静地燃烧生成C。把气体B通入到适量石灰乳中可以得到白色浑浊物D。请据此回答下列问题:
(1)写出下列各反应的化学方程式:
①纯净的A在B中安静地燃烧生成C:
②将气体B通入到水中:
③将气体B通入到NaOH溶液中:
④将气体B通入到适量石灰乳中:
(2)把三种气体分别通入酸性硝酸银溶液中,出现白色沉淀的气体是 (用字母表示)。
(3)白色浑浊物D因具有漂白性又称为 ,该物质在空气中容易变质的原因为 (用化学方程式表示)。
降低大气中CO2的含量及有效利用CO2,目前已引起各国普遍重视。
(1)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH--4e-=O2↑+2H2O,则阴极反应式为_________ ____ ___。
(2)工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,在500℃下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) 。
CH3OH(g)+H2O(g) 。
实验测得CO2(g)和CH3OH(g)的浓度随时间变化如下图1所示。
①图2是改变温度时H2的化学反应速率随时间变化的示意图,则该反应的正反应是(填“吸热”或“放热”)反应。
②500℃达平衡时,CH3OH的体积分数为。
(3) 右图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1molCH3OH(g)和2molH2O(g),向B容器中充入1.2molCH3OH(g) 和2.4molH2O(g),两容器分别发生上述(2)中反应的逆反应。已知起始时容器A和B的体积均为aL,反应达到平衡时容器B的体积为1.5aL,容器B中CH3OH转化率为 ;维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为 L(连通管中气体体积忽略不计,且不考虑温度的影响)。 
四种易溶于水的强电解质A、B、C、D由以下7种离子组成(电解质中阴离子各不相同)。
| 阳离子 |
Na+、 Ba2+、 NH4+ |
| 阴离子 |
CH3COO-、Cl-、OH-、SO42- |
已知:①A、C溶液显碱性,B溶液显酸性;②B和C的溶液混合反应的现象只是有刺激性气味的气体生成,C和D的溶液混合反应的现象只是有白色沉淀生成,A和D的溶液混合无明显现象。
(1)A是____,B是____。
(2)A溶液显碱性的离子方程式________。
(3) C与D的溶液反应的离子方程式________。
(4)将等体积、等物质的量浓度的B溶液和C溶液混合反应后溶液中各种离子浓度由大到小的顺序是
_______。
(5)向用盐酸中和后的C溶液中加入AgNO3和KBr,当两种沉淀共存时,c(Br—)/c(Cl—)=_________。(已知Ksp(AgCl) =2.0×10-10,Ksp(AgBr) =5.4×10-13)
(6)25℃时,0.1 mol·L-1 B溶液的pH=a,则B溶液中c(H+)—c(NH3·H2O)=(用含有a的关系式表示)。
根据下列化合物:①NaOH,②H2SO4,③CH3COOH, ④NaCl, ⑤CH3COONa, ⑥NH4Cl,⑦CH3COONH4,⑧NH4HSO4, ⑨NH3•H2O, 请回答下列问题:
(1)NH4Cl溶液中离子浓度大小顺序为;
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)=;在pH=3的CH3COOH 溶液中,水电离出来的c(H+)=;
(3)已知水存在如下平衡:H2O+ H2O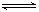 H3O++OH-△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是。
H3O++OH-△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是。
| A.向水中加入NaHSO4固体 | B.向水中加NaHCO3固体 |
| C.加热至100℃[其中c(H+)=1×10-6 mol•L-1] | D.向水中加入NH4Cl固体 |
(4)若浓度均为0.1 mol·L-1、等体积的NaOH和NH3•H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH都变成9,则 mn (填 “<”、“>”或“=”)。
(5)物质的量浓度相同的①、②、③、④、⑤、⑥六种稀溶液,按pH由大到小的顺序为(填序号)________。
(6) 物质的量浓度相同的⑥、⑦、⑧、⑨四种稀溶液中,NH 浓度由大到小的顺序是(填序号)。
浓度由大到小的顺序是(填序号)。
(7)已知t℃时,Kw=1×10-12,在该温度时将pH=9的NaOH溶液a L与pH=2的H2SO4溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=3,则a:b=______。
(10分)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下: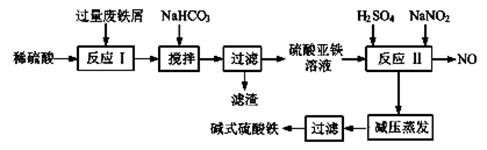
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
A1(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
①写出反应I中发生的氧化还原反应的离子方程式。
②加入少量NaHCO3的目的是调节溶液的pH,应控制pH的范围为。
③在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作氧化剂。若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为。
④碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子,该水解反应的离子方程式为。
工业上可利用煤的气化产物(CO和H2)合成二甲醚(CH3OCH3)同时生成二氧化碳,其三步反应如下:
① 2H2 (g)+CO(g) 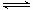 CH3OH (g) ΔH= -90.8 kJ·mol-1
CH3OH (g) ΔH= -90.8 kJ·mol-1
② 2CH3OH(g) 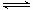 CH3OCH3(g)+H2O(g) ΔH= -23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH= -23.5 kJ·mol-1
③ CO(g)+H2O(g) 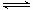 CO2 (g)+H2(g) ΔH= -41.3 kJ·mol-1
CO2 (g)+H2(g) ΔH= -41.3 kJ·mol-1
(1)总合成反应的热化学方程式为__________ _。
(2)一定条件下的密闭容器中,上述总反应达到平衡时,要提高CO的转化率,可以采取的措施是
__________(填字母代号)。
A高温高压 B加入催化剂 C减少CO2的浓度
D增加CO的浓度 E.分离出二甲醚
(3)已知反应②2CH3OH(g)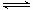 CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| c / mol·L-1 |
0.44 |
0.60 |
0.60 |
此时,v (正) _____ v (逆) (填“>”、“<”或“=”);达到平衡后,CH3OCH3的物质的量浓度是_____。