氧元素与多种元素具有亲和力,所形成化合物的种类仅次于碳元素。
(1)氮、氧、氟元素的第一电离能从大到小的顺序为 ,氧元素与氟元素能形成OF2分子,该分子的空间构型为 。
(2)根据等电子原理,判断NO2+离子中,氮原子轨道的杂化类型为 ,1molNO2+所含 键的数目为 。
键的数目为 。
(3)氧元素与过渡元素可以形成多种价态的金属氧化物。如铬可生成Cr2O3、CrO3等,试写出Cr3+核外电子排式 。
(4)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示:由此可判断该钙的氧化物的化学式为 。已知晶胞边长为540pm,则该氧化物的密度是 g·cm-3
有一瓶澄清溶液,其中只可能含有Na+、NH4+、Mg2+、Ba2+、Fe3+、Cl— 、SO42—、CO32— 离子(不考虑H+、OH—)。取该溶液进行以下实验:
(1)用pH试纸检验溶液,溶液呈酸性,
(2)另取部分溶液滴入NaOH溶液,使溶液从酸性逐渐变成碱性,无沉淀产生,
(3)取(2)中部分碱性溶液,滴加Na2CO3溶液,有白色沉淀析出,
(4)将(2)中剩余碱性溶液加热,有气体放出,该气体能使润湿的红色石蕊试纸变蓝色。
根据上述实验事实确定:
①该溶液中肯定存在的离子是;
②肯定不存在的离子是;
③可能存在的离子是。
在①CH2=CH2② ③CH3CH2OH ④CH3COOH ⑤聚乙烯五种物质中:
③CH3CH2OH ④CH3COOH ⑤聚乙烯五种物质中:
(1)属于高分子化合物的是;(请填物质的序号,下同。);
(2)能使Br2的CCl4溶液褪色的是;
(3)既能发生取代反应又能发生加成反应的是;
(4)能与Na2CO3溶液反应的是;
(5)能发生酯化反应的是;
钾水玻璃以其优异的性能广泛用于防腐、铸造、油田、钻井或各种高档涂料中。钾水玻璃中硅含量的测定可以采用氟硅酸钾容量法,其步骤为:
①称取试样溶解在含有过量的氟离子和钾离子的强酸溶液中,硅能与氟离子、钾离子作用生成氟硅酸钾(K2SiF6)沉淀;
②沉淀分离后于热水中水解,生成HF、H2SiO3、KF;
③过滤除去硅酸沉淀,用氢氧化钠标准溶液滴定滤液。
(1)上述步骤②中的水解反应方程式为;步骤③中反应的离子方程式为:。
(2)在步骤③中,若滴定前未用氢氧化钠标准溶液润洗滴定管,则测得的硅元素含量将(填“偏高”、或“偏低”或“不变”)。
(3)在步骤③中,需要 1.00 mol·L-1氢氧化钠标准溶液450mL,配制该溶液需用托盘天平称取___gNaOH固体。
高氯酸铵可用于火箭推进剂,实验室可由NaClO3等原料制取(部分物质溶解度如图),其实验流程如下:

(1)氯酸钠受热分解生成高氯酸钠和氯化钠的化学方程式为。
(2)80℃时浸取液冷却至0℃过滤,滤渣的主要成分为:(写化学式)。
(3)反应器中加入氯化铵饱和溶液发生反应的离子方程式为。
(4)已知:2NH4ClO4  N2↑+ 2O2↑ + Cl2↑ +4H2O,现可提供
N2↑+ 2O2↑ + Cl2↑ +4H2O,现可提供
下列试剂:a 饱和食盐水 b 浓H2SO4 c NaOH溶液 d Mg e Cu f Fe
利用下图装置对高氯酸铵热分解产生的三种气体进行分别吸收或收集。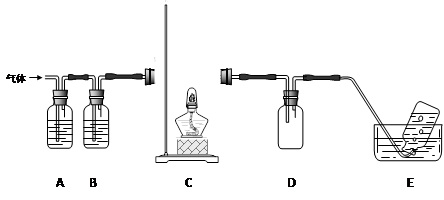
①E中收集到的气体可能是(填化学式) 。
②A、B、C中盛放的药品依次可以是(选填:Ⅰ、Ⅱ、Ⅲ)。
Ⅰ. a b dⅡ. c b eⅢ. b c f
(10分) 中学常见化学反应方程式为:A+B→X+Y+H2O(未配平,反应条件略去),其中,A、B的物质的量之比为1:4。请回答:
(1)若Y为黄绿色气体,该反应的离子方程式为,B体现出的化学性质有。
(2)若A为常见的非金属单质,B的溶液为某浓酸,反应条件为加热,其反应的化学方程式为。
(3)若A为某不活泼的金属单质,该反应能产生一种造成光化学烟雾的气体,该反应中氧化剂与还原剂的物质的量之比为。
(4)若A为常见的金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中。写出A与X的溶液反应的离子方程式。