次磷酸钠(NaH2PO2)可用于化学镀镍,即通过化学反应在塑料镀件表面沉积镍—磷合金。
(1)化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性条件下发生以下镀镍反应:
① Ni2+ + H2PO2-+ → Ni + H2PO3-+
② 6H2PO2- +2H+ →2P+4H2PO3-+3H2↑
请配平反应式①。
(2)反应式①中还原剂是 ,被还原元素是 。
(3)反应②中,若生成1 mol H2PO3-,反应中转移电子的物质的量为 。
(4)从二个化学镀镍反应分析,若生成1mol Ni和1mol P,同时有 mol H2PO3-生成。
(5)完成下列各小题中的化学反应方程式:碱金属与O2反应生成氧化物较复杂,有普通氧化物(如K2O)过氧化物(如K2O2)还有超氧化物和臭氧化物等。要制备碱金属的普通氧化物一般是用碱金属还原对应的过氧化物、硝酸盐或亚硝酸盐。写出下列化学反应式:
①钠与过氧化钠反应
②钾还原硝酸钾还产生了一种单质气体
已知可逆反应:
;
,
请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:
,
,达到平衡后,
的转化率为60%,此时
的转化率为。
(2)若反应温度升高,
的转化率(填"增大""减小"或"不变")。
(3)若反应温度不变,反应物的起始浓度分别为:
;达到平衡后,
,a=。
(4)若反应温度不变,反应物的起始浓度为:
,达到平衡后,
的转化率为。
-是一种新型硝化剂,其性质和制备受到人们的关注.
(1)
与苯发生硝化反应生成的硝基苯的结构简式是。
(2)
;
①反应达平衡后,若再通入一定量氮气,则
的转化率将 (填"增大"、"减小"、"不变")。
②下表为反应在T1温度下的部分实验数据:
|
|
0 |
500 |
1000 |
| e( )/ | 5.00 |
3.52 |
2.48 |
则500
内
的分解速率为。
③在
温度下,反应1 000
时测得
的浓度为4.98
,则
。
(3)如图所示装置可用于制备
,则
在电解池的区生成,其电极反应式为
。
 短周期元素Q、R、T、W在元素周期表中的位置如右图所示,期中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如右图所示,期中T所处的周期序数与主族序数相等,请回答下列问题:

(1)T的原子结构示意图为. (2)元素的非金属性为(原子的得电子能力):Q__W(填"强于"或"弱于")。
(2)元素的非金属性为(原子的得电子能力):Q__W(填"强于"或"弱于")。 (3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为.
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为. (4)原子序数比R多1的元素是一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是.
(4)原子序数比R多1的元素是一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是. (5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氯气相混合,若该混合气体被足量的
溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是.
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氯气相混合,若该混合气体被足量的
溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是. (6)在298K下,Q、T的单质各1
完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3
Q的单质,则该反应在298K下的
(6)在298K下,Q、T的单质各1
完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3
Q的单质,则该反应在298K下的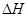 =(注:题中所设单质均为最稳定单质)
=(注:题中所设单质均为最稳定单质)
、
、
、
是周期表前36号元素中的四种常见元素,其原子序数一次增大。
、
的氧化物是导致酸雨的主要物质,
的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的
和黑色的ZO两种氧化物。 (1)
位于元素周期表第周期第_族。W的气态氢化物稳定性比
(1)
位于元素周期表第周期第_族。W的气态氢化物稳定性比 (填"强"或"弱")。
(填"强"或"弱")。 (2)
的基态原子核外电子排布式是,
的第一电离能比
的(填"大"或"小")。
(2)
的基态原子核外电子排布式是,
的第一电离能比
的(填"大"或"小")。 (3)
的最高价氧化物对应水化物的浓溶液与
的单质反应的化学方程式是
(3)
的最高价氧化物对应水化物的浓溶液与
的单质反应的化学方程式是

 (4)
的单质和
反应的热化学方程式是
(4)
的单质和
反应的热化学方程式是
A和B是具有相同碳原子数的一氯代物,A-I转换关系如图所示: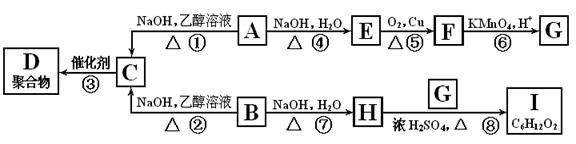
根据框图回答下列问题;
(1)B的结构简式是;
(2)反应③的化学方程式是;
(3)上述转换中属于取代反应的是;(填写反应序号)
(4)图中与E互为同分异构体的是;(填化合物代号)。图中化合物带有的含氧官能团有种。
(5)C在硫酸催化下与水反应的化学方程式是;
(6)I的结构简式是;名称是。