天然碱的组成可以用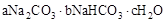 (a、b、c为整数)表示。现有A、B两种不同的天然碱样品,分别进行如下实验以确定其化学式。
(a、b、c为整数)表示。现有A、B两种不同的天然碱样品,分别进行如下实验以确定其化学式。
将质量为31.0 g的天然碱A于300℃加热分解至完全(300℃时Na2CO3不分解),产生CO2 2.24 L(标准状况)和水5.4 g。
(1)天然碱A的化学式中:
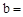

已知:Na2CO3与稀盐酸的反应分下列两步进行:
Na2CO3+HCl NaCl+NaHCO3 NaHCO3+HCl
NaCl+NaHCO3 NaHCO3+HCl NaCl+CO2↑+H2O
NaCl+CO2↑+H2O
将质量为12.45 g的天然碱B溶于水,逐滴滴加某浓度的稀盐酸,产生气体的体积与加入盐
酸的体积(标准状况)的关系如下表所示:
| 盐酸体积(mL) |
20 |
40 |
60 |
80 |
| 产生气体体积(mL) |
0 |
560 |
1680 |
2520 |
(2)由表中数据可推测加入50mL盐酸时,产生气体的体积为 mL(标准状况);盐酸的浓度为 mol/L;天然碱B的化学式为: 。
(3)若取一定质量的天然碱B加入到30mL该浓度的盐酸中,请写出产生气体体积V(mL,标准状况)与天然碱B质量W(g) 之间的关系式。
(10分)以乙烯为原料合成化合物C的流程如下所示:
(1)写出A的结构简式。
(2)反应①③的反应类型分别为、。
(3)写出乙醇的同分异构体。
(4)写出反应②和④的化学方程式:
②;④。
t℃时,将3mol A和1mol B气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g) xC(g),△H<0;在2min时反应达到平衡状态(温度不变)剩余了0.8molB,并测得C的浓度为0.4mol·L—1,请填写下列空白:
xC(g),△H<0;在2min时反应达到平衡状态(温度不变)剩余了0.8molB,并测得C的浓度为0.4mol·L—1,请填写下列空白:
(1)从开始反应至达到平衡状态,生成B的平均反应速率为。
(2)x=,平衡常数K=。
( 3)若继续向原平衡混合物的容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡(填字母)。
3)若继续向原平衡混合物的容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡(填字母)。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
(4)若向原平衡混合物的容器中再充入a mol C,在t℃时达到新的平衡,此时B的物质的量为n(B)=mol。
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系式为。
短周期元素A、B、C、D中,0.5mol A元素的离子得到6.02×1023个电子被还原为中性原子,0.4g A的氧化物恰好与100ml 0.2mol/L的盐酸完全反应,A原子核内质子数目与中子数目相等,B元素原子核外M层电子数目比K层多1个,C―比A元素的离子多1个电子层,D元素的原子核外L层比K层多2个电子。
(1)A、B、C、D四种元素的名称分别是、、、。
(2)画出C―和D原子的结构 示意图,
示意图,
(3)向B、C两种元素形成的化合物的水溶液里逐滴滴入苛性钠溶液,现象为__________,写出有关离子方程式_____________;________________。
镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。海水中主要含NaCl和MgCl2等。主要步骤如下;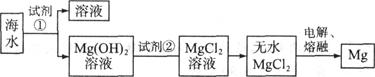
(1)为了使MgCl2转化为Mg(OH)2,试剂①可以选用___________,要使MgCl2完全转化为沉淀,加入试剂①的量应___________,验证MgCl2已完全转化为Mg(OH)2的方法是_______________________________。
(2)加入试剂①,能够分离得到Mg(OH)2沉淀的方法是 ____________________ 。
(3)试剂②可以选用___________________________。
(4)无水MgCl2在熔融状态下,通电后会产生Mg,写出该反应的化学方程式
(共计12分)
A.锌是一种重要的金属,锌及其化合物有着广泛的应用。
(1)葡萄糖酸锌[CH2OH(CHOH4COO)2Zn是目前市场上流行的补锌剂。写出Zn2+基
态电子排布式;葡萄糖[CH2OH(CHOH)4CHO]分子中碳原子杂化方式是。
(2)Zn2+也能与NH3形成配离子[Zn(NH3)4]2+。配位体NH3分子空间构型为;
在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在下图中
表示[Zn(NH3)4]2+中Zn2+与N之间的化学键。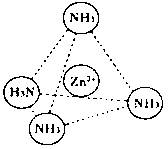
(3)下图表示锌与某种元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为;
该化合物的晶体熔点比干冰高得多,原因是。