T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物
质的量变化如图-1所示;若保持其他条件不变,温度分别为T1和T2,Y的体积百分
含量与时间的关系如图-2所示。下列分析正确的是 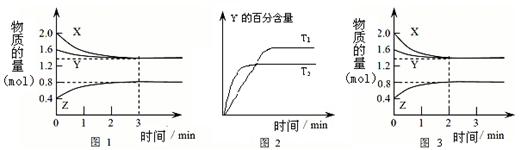
A.容器中发生的反应可表示为:3X(g)+Y(g) 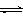 2Z(g) 2Z(g) |
| B.0~3 min内,v(X)=0.2 mol•L-1•min-1 |
| C.其他条件不变升高温度,v正、v逆都增大,且重新平衡前v正>v逆 |
| D.若改变条件,使反应进程如图-3所示,则改变的条件可能是增大压强 |
19世纪中叶,门捷列夫的突出贡献是
| A.提出原子学说 | B.发现元素周期律 |
| C.提出分子学说 | D.发现氧气 |
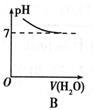
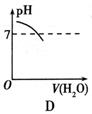
如图所示,能表示人体大量喝水时,胃液的pH变化的图像是

常温下,pH=13的强碱溶液与pH=2的强酸溶液混合,所得混合溶液的pH=11,则强碱与强酸的体积比是
| A.11:1 | B.9:1 | C.1:11 | D.1:9 |
用标准盐酸滴定未知浓度的NaOH溶液,如果测得结果偏低,则产生误差的原因可能是
| A.滴定过程中,锥形瓶中有溶液溅出 |
| B.锥形瓶用蒸馏水洗净后,未经干燥即进行滴定 |
| C.酸式滴定管未用标准盐酸润洗 |
| D.滴定前酸式滴定管尖嘴部分有气泡,滴定终止时气泡消失 |
常温下,下列四种溶液中,由水电离出的氢离子浓度之比为
①pH=0的盐酸 ②0.1 mol/L的盐酸 ③0.01 mol/L的NaOH溶液 ④pH=11的NaOH溶液
| A.1:10:100:1000 | B.0:1:12:11 |
| C.14:13:12:11 | D.14:13:2:3 |