为了测定铜铁合金中铜的质量分数,在10.00g试样中加入200mL、0.6mol/L的稀硝酸,充分反应后剩余金属7.48g,再向其中加入50mL、0.4mol/L的稀硫酸,充分振荡后剩余金属6.60g。若硝酸的还原产物只有NO,下列说法正确的是
| A.上述测定不能达到实验目的 | B.剩余的7.48g金属为铜 |
| C.共生成NO气体 0.04mol | D.该合金中铜的质量分数为69.2% |
某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示。则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为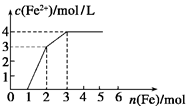
| A.1∶1∶1 | B.1∶3∶1 | C.3∶3∶8 | D.1∶1∶4 |
下列离子方程式正确的是()
| A.以石墨作电极电解氯化铝溶液:2Cl-+2H2O= 2OH-+H2↑+Cl2↑ |
| B.FeBr2溶液中通入足量氯气:2Fe2++2Br-+2Cl2 = 2Fe3++Br2+4Cl- |
| C.Fe3O4与HCl:Fe3O4+8H+=2Fe3++Fe2++4H2O |
| D.Fe2O3与HI:Fe2O3+6H+=2Fe3++3H2O |
将4 g铝铁合金粉末溶于足量盐酸中,加入过量氢氧化钠溶液,过滤后向滤液中通入足量二氧化碳,再将沉淀滤出,经洗涤、干燥、灼烧后得到固体粉末的质量仍为4 g,原合金中铁的质量分数最接近( )
| A.30% | B.47% | C.53% | D.70% |
有Cu、Fe、Mg、Al四种金属,若两两混合,取混合物26g与足量稀硫酸作用,产生11.2L氢气(标准状况下),则混合物可能的组合方式最多有( )
| A.2种 | B.3种 | C.4种 | D.5种 |
将1.95g锌粉加入到200mL的0.100 mol·L-1MO2+溶液中,恰好完全反应,则还原产物可能是()
| A.M | B.M2+ | C.M3+ | D.MO2+ |