某一固体物质可能由NaOH、AlCl3、MgCl2中的几种组成,取其一定量溶于水,有沉淀产生,在所得悬浊液中逐滴加入5mol/L的盐酸,下图表示盐酸加入量与沉淀量的变化关系,图中M点表示已加入的盐酸体积,则M点的体积是( )
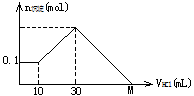
| A.70mL | B.100mL | C.120mL | D.130mL |
下列关于强、弱电解质的叙述,正确的是
| A.强电解质全部是离子化合物 |
| B.强电解质在水中的溶解度一定大于弱电解质 |
| C.强电解质在水溶液中完全电离 |
| D.强电解质溶液的导电能力一定强于弱电解质 |
已知下列反应的平衡常数:①H2(g)+S(s)⇌H2S(g)K1②S(s)+O2(g)⇌SO2(g) K2则相同温度下,反应H2+SO2⇌O2+H2S的平衡常数为
| A.K1+K2 | B.K1﹣K2 | C.K1×K2 | D.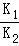 |
下列离子方程式正确的是
| A.向FeSO4溶液中加入少量Na2O2:4Na2O2+6H2O+4Fe2+===4Fe(OH)3↓+8Na++O2↑ |
| B.向明矾溶液中逐滴加入Ba(OH)2溶液至沉淀的质量最大:2Al3++3SO42-+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓ |
| C.向NaClO溶液中通入少量SO2: 2ClO-+SO2+H2O===2HClO+SO32- |
| D.将0.2 mol/L的NH4Al(SO4)2溶液与0.4 mol/L的Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-===Al(OH)3↓+2BaSO4↓+NH3·H2O |
已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且 的值与温度高低有关。当n(KOH)=a mol时,下列有关说法错误的是
的值与温度高低有关。当n(KOH)=a mol时,下列有关说法错误的是
A.若某温度下,反应后 =11,则溶液中 =11,则溶液中 = = |
B.参加反应的氯气的物质的量等于 a mol a mol |
C.改变温度,产物中KClO3的最大理论产量为 a mol a mol |
D.改变温度,反应中转移电子的物质的量ne的范围: a mol≤ne≤ a mol≤ne≤ a mol a mol |
1.52 g铜镁合金完全溶解于50 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
| A.得到2.54 g沉淀时,加入NaOH溶液的体积是700 mL |
| B.该合金中铜与镁的物质的量之比是2:1 |
| C.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L |
| D.NO2和N2O4的混合气体中,NO2的体积分数是80% |