相对分子质量为92的某芳香烃X是一种重要的有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。其中A是一氯代物,H是一种功能高分子,链节组成为C7H5NO。
已知:
Ⅰ、
Ⅱ、
请根据所学知识与本题所给信息回答下列问题:
(1)H的结构简式是: ;X→A的反应条件 。
(2)反应②的类型是 ;反应②和③先后顺序不能颠倒的原因是 ;
(3)写出反应①的化学方程式: ;
(4) 有多种同分异构体,写出2种含有1个醛基和2个羟基且苯环上只有2种一氯取代物的芳香族化合物的结构简式: ;
有多种同分异构体,写出2种含有1个醛基和2个羟基且苯环上只有2种一氯取代物的芳香族化合物的结构简式: ;
(5)写出由A转化为 的路线。(用A→ …… →
的路线。(用A→ …… → 在箭号上写明反应试剂及反应条件。)
在箭号上写明反应试剂及反应条件。)
用辉铜矿(主要成分为 Cu2S,含少量Fe2O3、SiO2,等杂质)制备难溶于水的碱式碳酸铜的流程如下:
(1)下列措施是为了加快浸取速率,其中无法达到目的的是____(填字母)。
| A.延长浸取时间 | B.将辉铜矿粉碎 |
| C.充分搅拌 | D.适当增加硫酸浓度 |
(2)滤渣I巾的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S的离子方程式:_______。
(3)研究发现,若先除铁再浸取,浸取速率明显变慢,可能的原因是___________。
(4)“除铁”的方法是通过调节溶液pH,使Fe3+转化为Fe(OH)3,则加入的试剂A可以是_______(填化学式);“赶氨”时,最适宜的操作方法是________。
(5)“沉锰”(除Mn2+)过程中有关反应的离子方程式为_______。
(6)滤液Ⅱ经蒸发结晶得到的盐主要是___________(填化学式)。
(16分)为治理环境,减少雾霾,应采取措施减少二氧化硫、氮氧化物(NOx)和CO2的排放量。
I.处理NOx的一种方法是利用甲烷催化还原NOx。
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=—574 kJ/mol
②CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H2=—867kJ/mol
(1)若用4.48LCH4还原NO生成N2,则放出的热量为______kJ。(气体体积已折算为标准状况下)
(2)NOx可用强碱溶液吸收产生硝酸盐。在酸性条件下,FeSO4溶液能将NO3-还原为NO,NO能与多余的FeSO4溶液作用生成棕色物质,这是检验NO3-的特征反应。电解的原理如图所示
则:写出该过程中产生NO的离子方程式:____________。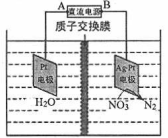
(3)电解时阴极的电极反应式为____;当电路中转移20 mol电子时,交换膜左侧溶液质量减少________g。
Ⅲ利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s) 5CO2(g)+I2(s)。不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 molCO,测得CO2的体积分数(
5CO2(g)+I2(s)。不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 molCO,测得CO2的体积分数(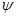 )随时间(t)变化曲线如图。
)随时间(t)变化曲线如图。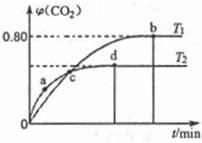
回答:
(4)T1时,该反应的化学平衡常数的数值为____。
(5)下列说法不正确的是_______(填字母)。
| A.容器内气体密度不变,表明反应达到平衡状态 |
| B.两种温度下,c点时体系中混合气体的压强相等 |
| C.d点时,在原容器中充入一定量氦气,CO的转化率不变 |
| D.b点和d点时化学平衡常数的大小关系:Kb<Kd |
Ⅳ.以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4通过反应CO2(g)+CH4(g) CH3COOH(g)△H<0直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。
CH3COOH(g)△H<0直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。
(6)①250—300℃时,乙酸的生成速率减小的主要原因是_______。
②工业生产中该反应的温度常选择250℃、不选择400℃,从综合经济效益考虑,其原因是_______。
选做(12分)【化学——物质结构与性质】第二周期中碳、氮、氧是构成生命物质的三种主要元素,其单质及化合物在生产生活中也有着重要的应用。
(1)第二周期中,元素的第一电离能处于B与N之间的元素有_________种。
(2)某元素位于第四周期VIII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的价层电子排布式为_________________________。
(3)乙烯酮(CH2=C=O)是一种重要的有机中间体,可用CH3COOH在痕量(C2H5O)P=O存在下加热脱H2O得到。乙烯酮分子中碳原子杂化轨道类型是________。CH3COOH的沸点比HCOOCH3高的主要原因是_______________________。
(4)CH2=CHCN是制备晴纶的原料,其分子中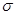 键和
键和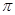 键的个数之比为______(填最简整数比)。
键的个数之比为______(填最简整数比)。
(5)碳化硅的结构与金刚石类似,其硬度仅次于金刚石,具有较强的耐磨性能。每个碳原子周围与其距离最近的硅原子有________个。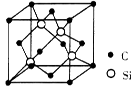
(17分)氮及其化合物在工业生产和科技等领域有广泛应用。
(1)肼(N2H4)常用于火箭或原电池的燃料。已知:(i)N2(g)+2O2(g)=2NO2(g) ΔH=+67.7kJ/mol
(ii)N2H4(g)+ O2(g)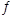 N2(g)+2H2O(g) ΔH=-534kJ/mol
N2(g)+2H2O(g) ΔH=-534kJ/mol
(iii)H2O(g)= H2O(1)ΔH=-44kJ/mol
①反应2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l)ΔH =_______kJ·mol-1
②一定温度下,将N2H4与NO2以体积比1:1置于10 L密闭容器中发生反应2N2H4(g)+ 2NO2(g)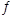 3N2(g)+4H2O(1),下列不能说明反应达到平衡状态的是_______。(填序号)
3N2(g)+4H2O(1),下列不能说明反应达到平衡状态的是_______。(填序号)
a.混合气体密度保持不变b.混合气体颜色保持不变
c.N2H4与NO2体积比保持不变 d.体系压强保持不变
③在10 L的密闭容器中发生上述反应,容器内部分物质的物质的量变化如下表:
前2min内NO2的平均反应速率为___________。平衡时NO2的转化率________;该温度下反应的平衡常数K=_________。
反应在第6min时改变了条件,改变的条件可能是__________。(填序号)
a.使用催化剂b.升高温度c.减小压强d.增加NO2的量
(2)HNO3和As2S3能发生反应:As2S3+10HNO3==2H3AsO4+3S+10NO2↑+2H2O,反应中被氧化的元素为_________。
若该反应中转移电子的物质的量为5 mol时,产物中的S经过转化全部生成浓H2SO4,然后与足量的铜在加热条件下反应消耗铜的量_________。(填序号)
a.小于0.75 molb.等于0.75mol c.大于0.75mold.无法确定
硫铁矿烧渣是一种重要的化工生产中间产物,主要成分是Fe3O4、Fe2O3、FeO和二氧化硅等。下面是以硫铁矿烧渣制备高效净水剂聚合硫酸铁的流程图: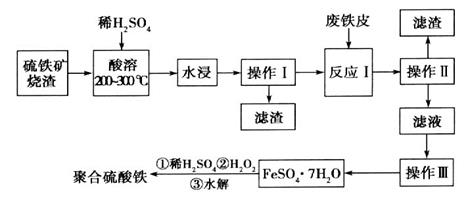
(1)实验室实现“操作I”所用的玻璃仪器有_______、________和烧杯。
(2)检验“酸溶”后的溶液中含有Fe2+试剂是_______,现象是_______。
(3)“操作III”系列操作名称依次为______、______、过滤和洗涤。洗涤的方法是______________。
(4)加入适量H2O2的目的是氧化Fe2+,写出H2O2氧化Fe2+为Fe3+的离子方程式:__________________。