下列离子方程式中,正确的是
A.Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+ SO42-+3S↓+2H2O SO42-+3S↓+2H2O |
B.向NaAlO2溶液中通入过量CO2:2AlO2- + CO2+ 3H2O  2Al(OH)3 + CO32- 2Al(OH)3 + CO32- |
C.FeS溶于过量稀硝酸中:FeS + 2H+ Fe2+ + H2↑ Fe2+ + H2↑ |
D.双氧水中加入稀硫酸和KI溶液: H2O2+ 2I-+2H+ I2+ 2H2O I2+ 2H2O |
已知戊烷有3种同分异构体,戊醇的同分异构体(属于醇类)的数目有()
| A.5种 | B.6种 | C.7种 | D.8种 |
10ml某气态烃与50mlO2 在密闭容器中点燃,烃和氧气全部耗尽,测得生成40mlH2O(g)、20mlCO2和20mlCO(气体体积均在同温同压下测定)该烃的分子式是()
| A.C2H4 | B.C3H8 | C.C4H8 | D.C4H10 |
下列各组中的反应,属于同一反应类型的是 ( )
| A.由溴丙烷水解制丙醇;由丙烯与水反应制丙醇 |
| B.由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸 |
| C.由氯代环己烷消去制环己烯;由丙烯加溴制1,2-二溴丙烷 |
| D.由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇 |
下列各醇中,能发生消去反应生成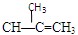 的是()
的是()
有机物的种类繁多,但其命中是有规则的。下列有机物命名正确的是()