以A为原料合成安眠药——苯巴比妥的路线如下:
已知:
(1)A中官能团的名称是 。
(2)B→C的化学方程式是 。
(3)写出一种与D互为同分异构体,且苯环上只有一个取代基的酯的结构简式 。
(4)F为酯,其结构简式是 。 (5)F→G的反应类型是 。
(5)F→G的反应类型是 。
(6)H的结构简式是 。
(7)G与CO(NH2)2在一定条件下合成的高分子结构简式是 。
有一化学反应2A B+D ,B、D起始浓度为0,在四种不同条件下进行。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表,根据下述数据,完成填空:
B+D ,B、D起始浓度为0,在四种不同条件下进行。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表,根据下述数据,完成填空: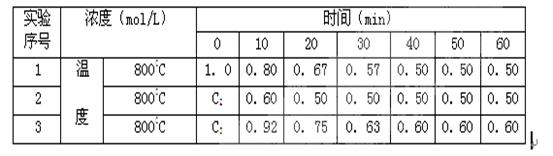
(1)在实验1,反应在0至20分钟时间内A的平均速率为mol/(L·min)。
(2)在实验2,A的初始浓度C2=mol/L,可推测实验2中隐含的条件是。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则达到平衡时v3v1(填>、=、<=,)800℃时,反应平衡常数=,且C3=mol/L,可推测实验3中隐含的条件是。
(4)800℃时,反应B+D  2A当其他条件不变, B、D的起始浓度为0.50 mol/L , A的起始浓度为0, 达到平衡时A的浓度为mol/L, B的转化率=。
2A当其他条件不变, B、D的起始浓度为0.50 mol/L , A的起始浓度为0, 达到平衡时A的浓度为mol/L, B的转化率=。
如图为相互串联的甲乙两个电解池,请回答: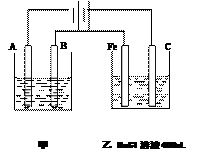
(1)甲池若为电解精炼铜的装置,A极是,材料是,电极反应为 ,
,
B极是,材料是,电极反应为,电解质溶液为。
(2)若甲槽阴极增重12.8g,则乙槽阴极放出气体在标准状况下的体积为。
(3)若乙槽剩余液体为400mL,求电解后得到碱液的物质的量浓度。
反应A(g)+B(g)  C(g) +D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题。
C(g) +D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题。
①图中E1代表的意义是。
该反应是反应(填“吸热”、“放热”)。反应热△H的表达式为。
②当反应达到平衡时,升高温度,A的转化率(填“增大”、“减小”或“不变”)。
③ 在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1, E2(填“增大”、“减小”或“不变”)。化学平衡移动(填“向左”、“向右”或“不”)。
将6 mol H2和3 mol CO充入容积为0.5 L的密闭容器中,进行如下反应:2 H2(气) + CO(气) 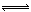 CH3OH(气),6秒时体系达到平衡,此时容器内气体的物质的量为开始时的0.6倍,求(1)H2的反应速率;
CH3OH(气),6秒时体系达到平衡,此时容器内气体的物质的量为开始时的0.6倍,求(1)H2的反应速率;
(2)CO的转化率;
(3)求相同条件下CH3OH(气) 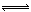 2 H2(气) + CO(气)的平衡常数K
2 H2(气) + CO(气)的平衡常数K
下图是某工厂生产甲醇(CH3OH)的工艺流程图: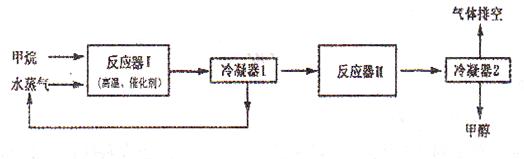
已知,在反应器II中CO在高温、高压、催化剂存在的条件下跟H2充分反应后,仍剩余1/3。请回答下列问题:
(1)在反应器I中,发生反应的化学方程式是_______________________ _____________。
_____________。
(2)从提高原子的利用率出发,该生产工艺需要进行的改进是_____________________。
(3)右图表示CO和H2反应合成甲醇过程中的能量变化,曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂时反应的能量变化。则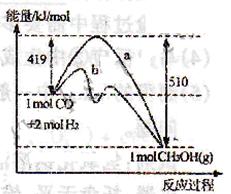
①反应的热化学方程式为___________________________________________。
②在恒容条件下,能使该反应的平衡常数改变的措施有_________________。(填字母)
| A.加压 |
| B.降低温度 |
| C.再充入1mol CO和2molH2 |
| D.使用更高效的催化剂。 |