汽车尾气中NOx的消除及无害化处理引起社会广泛关注。
(1)某兴趣小组查阅文献获得如下信息:
N2(g)+O2(g)=2NO(g) △H=+180.5kJ/mol
2H2(g)+O2(g)=2H2O(g)) △H=―483.6kJ/mol
则反应2H2(g)+2NO(g)=2H2O(g)+N2(g) △H= 。
(2)该小组利用电解原理设计了如图1装置进行H2还原NO的实验[高质子导电性的SCY陶瓷(能传递H+)为介质,金属钯薄膜做电极]。
钯电极A为 极,电极反应式为 。
(3)氨法催化还原NO原理如下:
主反应:4NO(g)+4NH3(g)+O2(g) 4N2(g)+6H2O(g) (△H <0)
4N2(g)+6H2O(g) (△H <0)
副反应:4NH3(g)+3O2(g) 2N2(g)+6H2O(g)
2N2(g)+6H2O(g)
4NH3(g)+ 4O2(g) 2N2O(g)+6H2O(g)
2N2O(g)+6H2O(g)
4NO(g)+4NH3(g)+3O2(g) 4N2O(g)+6H2O(g)
4N2O(g)+6H2O(g)
有关实验结论如图2、图3所示,据此回答以下问题:
①催化还原NO应控制n(NH3)/n(NO)的最佳值为 ,理由是 。
②主反应平衡常数表达式:K= ,随着温度的增加,K将 (选填“增加”、 “减小”或“不变”。
③影响N2O生成率的因素有 、氧气浓度和 。
在酸性条件下:
①KBrO3能将KI氧化成I2或KIO3,其本身被还原成Br2;
②KIO3能将I-氧化为I2,也能将Br-氧化成Br2,其本身被还原成I2。
(1)上述反应所涉及到的粒子氧化性最强的是(填离子符号);
(2)写出一个能证明氧化性Br2>I2的离子方程式;
(3)向含有KI、H2SO4的溶液中加入KBrO3溶液,若氧化产物、还原产物只有I2和Br2,写出反应的化学方程式,并标明电子转移方向和数目。
_______________________________________________________;
其中被氧化的元素是_________,要得到1mol还原产物转移电子数目为____________。
四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料,由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下:
回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生。
2Fe3++Fe === 3Fe2+
2TiO2+(无色) +Fe+4H+=== 2Ti3+(紫色) +Fe2++2H2O
Ti3+(紫色) +Fe3++H2O ="==" TiO2+(无色) +Fe2++2H+
加入铁屑的作用是____________________________________________________________。
(2)在②→③工艺中需要控制条件以形成TiO2·n H2O溶胶,该分散质颗粒直径大小在____________________范围。
(3)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是_____________________________________(只要求写出一项)。
(4)依据下表信息,要精制含少量SiCl4杂质的TiCl4 ,可采用_____________方法。
| |
TiCl4 |
SiCl4 |
| 熔点/℃ |
-25.0 |
-68.8 |
| 沸点/℃ |
136.4 |
57.6 |
下图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题: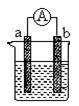
(1)当电极a为Al、电极b为Cu、电解质溶液为稀硫酸时,正极的电极反应式为:
。
(2)当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠溶液时,该装置(填“能”或“不能”)形成原电池,若不能,请说明理由,若能,请指出正、负极。
(3)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。
现设计一燃料电池,以电极a为正极,电极b为负极,氢气为燃料,采用碱性溶液为电解液;则氢气应通入极(填a或b,下同),电子从极流出。a极发生电极反应式为:_____________________________。
将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)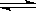 xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1mol/(L.min)。试求:
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1mol/(L.min)。试求:
(1)此时A的浓度为,反应开始前容器中A、B的物质的量为;
(2) B的平均反应速率为;
(3)x=。
下表是元素周期表的一部分,表中的每个字母表示一种短周期元素,回答下列问题: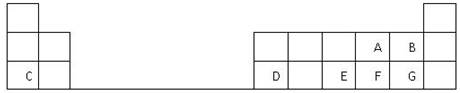
(1)画出A的原子结构示意图__________。
(2)A、B、E、F、G五种元素所形成的气态氢化物最不稳定的是__________(填化学式)。
(3)D在元素周期表中的位置是第3周期第________族。
(4)E、F元素的最高价氧化物对应水化物的酸性较强的是____________(填化学式)。
(5)写出C和F形成的化合物的电子式________________________。
(6)A、C、D 的离子半径大小关系是___________________ (用离子符号表示)