某酸性工业废水中含有K2Cr2O7。光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4 ·4H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下
(1)在25°C下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。
| 实验编号 |
初始 pH |
废水样品 体积/mL |
草酸溶液 体积/mL |
蒸馏水 体积/mL |
| ① |
4 |
|
10 |
30 |
| ② |
5 |
60 |
10 |
|
| ③ |
|
60 |
|
20 |
测得实验①和②溶液中的Cr2O72-浓度随时间变化关系如图所示。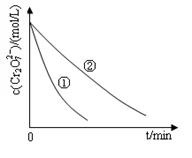
(2)实验①和②的结果表明_______________________________;
(3)该课题组队铁明矾[Al2Fe(SO4)4 ·4H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;假设二: ;假设三: ;……
(4)请你设计实验验证上述假设一,完成下表中内容。(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4·Al2(SO4)3·24H2O、Al2(SO4)3等。(溶液中Cr2O72-的浓度可用仪器测定)
| 实验方案(不要求写具体操作过程) |
预期实验结果和结论 |
| 取_______________________________代替实验①中的铁明矾,控制其他反应条件与实验①相同,进行对比实验 |
反应进行相同时间后 若溶液中的Cr2O72-浓度____________________________则假设一成立; 若溶液中的Cr2O72-浓度____________________________则假设一不成立; |
某化学兴趣小组的同学选定稀硫酸和氢氧化钡溶液做中和反应的实验。在烧杯中加入一定量的氢氧化钡溶液后滴入几滴酚酞试液,再向烧杯中加入一定量的稀硫酸。用玻璃棒充分搅拌后过滤,得白色沉淀和无色液体。
【提出问题】无色液体是什么物质?(不考虑指示剂)
【猜想】①小明:无色液体是水;
②小岩:无色液体是Ba(OH)2溶液;
③小丽认为无色液体可能是溶液。
【实验探究】
(1)如果你是小组成员之一,你认为小明猜想的理由是;写出反应的离子方程式。
(2)你认为小岩的猜想(“正确”或“不正确”)。理由是。
(3)填写小丽的猜想,并针对她的猜想,请你设计实验验证是否正确。
| 实验步骤 |
实验现象及结论 |
【拓展应用】
(4)中和反应在生产、生活中应用十分广泛,其中医疗上可以借助中和反应,来减轻胃酸过多病人的痛苦。根据你所学的知识判断下列物质适合用来中和胃酸的是。
A.氢氧化钡B.碳酸氢钠C.氢氧化钠 D.氢氧化铝
某化学课外小组利用下图装置探究SO2的性质。请回答下列问题:
(1)仪器A的名称是;写出烧瓶内发生反应的化学方程式:。
(2)装置乙中高锰酸钾溶液褪色可以证明SO2具有(填代号);装置丙中发生反应的化学方程式
为;可以证明SO2具有(填代号)。
| A.氧化性 | B.还原性 | C.漂白性 | D.酸性 |
(3)从环保的角度考虑,该装置尾部需要连接一个盛有(填化学式)溶液的洗气瓶。
某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究。
向2支盛有1 mL 1 mol/L的MgCl2溶液中各加入10滴2 mol/L NaOH,制得等量Mg(OH)2沉淀;然后分别向其中加入不同试剂,记录实验现象如下表:
| 实验序号 |
加入试剂 |
实验现象 |
| Ⅰ |
4 mL 2mol/LNH4Cl 溶液 |
沉淀溶解 |
| Ⅱ |
4 mL蒸馏水 |
沉淀不溶解 |
(1)测得实验Ⅰ中所用NH4Cl溶液显酸性(pH约为4.5),用离子方程式解释其显酸性的原因。
(2)同学们猜测实验Ⅰ中沉淀溶解的原因有两种:
猜想1:氢氧化镁电离出OH-离子,与氯化铵电离出来的铵根离子反应生成氨水.
猜想2:。
(3)为验证猜想,又设计了以下实验
| 序号 |
实验内容 |
结果 |
| 1 |
测定醋酸铵溶液的pH |
pH约为7,溶液呈中性 |
| 2 |
取少量的相同质量的氢氧化镁分别盛放在试管中,分别向其中滴加醋酸铵溶液和氯化铵溶液 |
固体均溶解 |
①用醋酸铵溶液与氢氧化镁反应的原因是。
②实验证明猜想正确的是(填“1”或“2”)。
(4)实验Ⅱ观察到沉淀不溶解。该实验的目的是。
氧化还原滴定实验同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。现有0.01 mol·L-1KMnO4酸性溶液和未知浓度的无色NaHSO3溶液。反应离子方程式是2MnO4-+5HSO3-+H+ 2Mn2++5SO42-+3H2O。填空回答问题:
2Mn2++5SO42-+3H2O。填空回答问题:
(1)滴定过程中用到的玻璃仪器除了酸式滴定管、碱式滴定管外还缺少_____________________
(2)不用________(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液。试分析原因:
(3)选何种指示剂,说明理由,到达终点时颜色变化
(4)当用酸滴定碱时,下列操作使测定结果(碱的浓度)偏高的是
① 酸式滴定管滴至终点,俯视读数
② 碱液移入锥形瓶后,加入10mL蒸馏水
③ 酸式滴定管注入酸溶液后,尖嘴有气泡时便开始滴定,滴定后无气泡
④ 酸式滴定管用蒸馏水润洗后,未用标准液润洗
(5)有关数据记录如下:
| 实验序号 |
待测液体积(mL) |
所消耗KMnO4酸性溶液的体积(mL) |
|
| 滴定前 |
滴定后 |
||
| 1 |
20.00 |
0.50 |
20.60 |
| 2 |
20.00 |
6.00 |
25.90 |
| 3 |
20.00 |
1.40 |
24.20 |
则NaHSO3溶液的物质的量浓度为______________mol/L。
某小组同学要配制100 mL 0.100 mol·L-1 Na2CO3溶液。下图是一些关键步骤和操作。
(1)配制过程的先后顺序为(用字母A~F填写)。
(2)配制过程所需的玻璃仪器有烧杯、玻璃棒、量筒、。
(3)用Na2CO3·10H2O来配制溶液,若晶体已经部分失去结晶水,则所配得溶液的浓度会(填“偏高”、“偏低”、“不变”)。
(4)步骤A通常称为洗涤,如果没有步骤A,则配得溶液的浓度将(填“偏高”、“偏低”、“不变”);步骤F称为,如果俯视刻度线,配得溶液的浓度将(填“偏高”、“偏低”、“不变”)。
(5)在步骤B之后,需,才进行下一步操作。