下列说法中正确的是
| A.Ag+ + Cl- =" AgCl↓" 的反应属于化合反应 |
| B.按照分散剂粒子的直径大小可将分散系分为溶液、胶体和浊液 |
| C.可以利用丁达尔效应区分胶体和溶液 |
| D.晶体硅是制造光导纤维的原料 |
在一定条件下,Na2CO3溶液中存在水解平衡:CO32-+H2O HCO3-+OH-。下列说法正确的是
HCO3-+OH-。下列说法正确的是
| A.稀释溶液,水解平衡常数增大 | B.通入CO2,平衡向正反应方向移动 |
C.升高温度,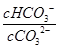 减小 减小 |
D.加入NaOH固体,溶液pH减小 |
25 ℃时,在PbI2饱和溶液中,存在着平衡PbI2(s) Pb2+(aq)+2I-(aq),若再加入少量PbI2固体,下列说法不正确的是
Pb2+(aq)+2I-(aq),若再加入少量PbI2固体,下列说法不正确的是
| A.溶液中Pb2+和I-浓度都增大 | B.溶度积常数Ksp不变 |
| C.沉淀溶解平衡不移动 | D.溶液中Pb2+和I-浓度不变 |
HA为酸性略强于醋酸的一元弱酸.在0.1 mol·L-1 NaA溶液中,离子浓度关系正确的是
| A.c(Na+)>c(A-)>c(H+)>c(OH-) | B.c(Na+)>c(OH-)>c(A-)>c(H+) |
| C.c(Na+)+c(OH-)=c(A-)+c(H+) | D.c(Na+)+c(H+)=c(A-)+c(OH-) |
醋酸溶液中存在电离平衡CH3COOH H++CH3COO-,下列叙述不正确的是
H++CH3COO-,下列叙述不正确的是
| A.升高温度,平衡正向移动,醋酸的电离常数Ka值增大 |
| B.0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)增大 |
| C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动 |
| D.25℃时,欲使醋酸溶液的pH、电离常数Ka和电离程度都减小,可加入少量冰醋酸 |
下列说法正确的是
| A.pH<7的溶液一定是酸性溶液 |
| B.室温时,pH=5的溶液和pH=3的溶液相比,前者c(OH-)是后者的100倍 |
| C.室温下,每1×107个水分子中只有一个水分子发生电离 |
| D.HCl溶液中无OH-,NaOH溶液中无H+,NaCl溶液中既无OH-也无H+ |