某氯化镁溶液的密度为1.18g/cm3,其中镁离子的质量分数为5.1%,300mL该溶液中氯离子的物质的量为
| A.0.37mol | B.0.63mol | C.0.74mol | D.1.5mol |
设阿伏加德常数为NA。则下列说法正确的是
| A.常温常压下,11.2L甲烷中含有的氢原子数为2NA |
| B.标准状况下,0.3mol二氧化硫中含有氧原子数为0.3NA |
| C.常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA |
| D.常温下,1L 0.1mol/L MgCl2溶液中含Mg2+数为0.2NA |
在溶液中能大量共存的一组离子或分子是
| A.NH4+、H+、NO3-、HCO3- |
| B.K+ 、Al3+、SO42-、NH3·H2O |
| C.Na+、K+、SO32-、Cl2 |
| D.Na+ 、CH3COO-、CO32-、OH- |
甲:在试管中加入1 g粉末状大理石,加入4 mol/L盐酸20 mL(过量);
乙:在试管中加入2 g颗粒状大理石,加入4 mol/L盐酸20 mL(过量);
下列CO2生成体积(折算成标准状况)V(CO2)同反应时间t的关系曲线图合理的是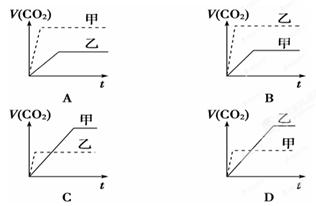
有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
由此可判断这四种金属活动性顺序是
| A.a>b>c>d | B.b>c>d>a | C.d>a>b>c | D.a>b>d>c |
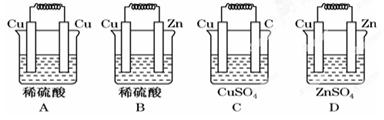
如图所示能够组成原电池,并且产生明显的电流的是