小明很喜欢化学实验课,今天要学习“探究铁及其化合物的氧化性或还原性”,现邀你一起走进他的化学课堂。
(1)课前老师布置了下列预习作业,请你一起完成:
①铁不同价态的物质各写一种(并标出铁元素的化合价):_____、_______、 ________。
②写出一个它们之间相互转化(含三种价态)的化学方程式:___________________ 。
(2)实验室提供的下列试剂:锌粒、铁粉、0.1 mol·L-1 FeCl3溶液、0.1 mol·L-1 FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+、Fe3+的氧化性、还原性。
根据氧化还原反应的有关原理,小明说Fe2+既有还原性又有氧化性,为证实自己的假设,请你和小明一起设计实验方案,进行实验并描述实验现象,完成下列表格。
| 探究内容 |
实验方案 |
实验现象 |
| 探究Fe2+具有还原性 |
取少量0.1 mol·L-1 FeCl2溶液,加入足量__________后,再往溶液中加入少量__________ |
溶液变成血红色 |
| 探究Fe2+具有氧化性 |
取少量0.1 mol·L-1 FeCl2溶 液,加入_________充分 反应 |
溶液由浅绿色变无色 所发生反应离子方程式为________________ |
固态化合物
由两种短周期元素组成,可与水放生复分解反应,甲组同学用如图装置(夹持装置略)对其进行探究实验。
(1)仪器
的名称是。
(2)试验中,Ⅱ中的试纸变蓝,Ⅳ中黑色粉末逐渐变为红色并有M生成,则Ⅲ中的试剂为;Ⅳ发生反应的化学方程式为;Ⅴ中的试剂为。
(3)乙组同学进行同样实验,但装置连接顺序为Ⅰ--Ⅱ--Ⅲ--Ⅳ--Ⅴ--Ⅵ,此时Ⅱ中现象为,原因是。
(4)经上述反应,2.5g化合物
理论上可得0.56L(标准状况)
;则
的化学式为.
氢化钙固体是登山运动员常用的能源提供剂。某兴趣小组长拟选用如下装置制备氢化钙。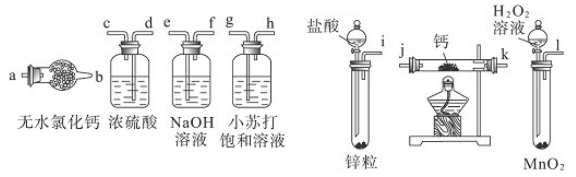
请回答下列问题:
(1)请选择必要的装置,按气流方向连接顺序为(填仪器接口的字母编号)
(2)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞(请按正确的顺序填入下列步骤的标号)。
| A. | 加热反应一段时间 | B. | 收集气体并检验其纯度 |
| C. | 关闭分液漏斗活塞 | D. | 停止加热,充分冷却 |
(3)实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,该同学据此断,上述实验确有
生成。
① 写出
与水反应的化学方程式
②该同学的判断不正确,原因是
(4)请你设计一个实验,用化学方法区分钙与氢化钙,写出实验简要步骤及观察到的现象。
(5)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是。
三草酸合铁酸钾晶体(
)是一种光敏材料,在110℃可完全失去结晶水。为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
(1)铁含量的测定
步骤一:称量5.00
三草酸合铁酸钾晶体,配制成250
溶液。
步骤二:取所配溶液25.00
于锥形瓶中,加稀
酸化,滴加
溶液至草酸根恰好全部氧化成二氧化碳,同时,
被还原成
。向反应后的溶液中计入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性。
步骤三:用0.010
溶液滴定步骤二所得溶液至终点,消耗
溶液20.02ml滴定中
,被还原成
。
重复步骤二、步骤三操作,滴定消耗0.010
溶液19.98
请回答下列问题:
①配制三草酸合铁酸钾溶液的操作步骤依次是:称量、、转移、洗涤并转移、摇匀。
②加入锌粉的目的是。
③写出步骤三中发生反应的离子方程式。
④实验测得该晶体中铁的质量分数为。在步骤二中,若加入的
的溶液的量不够,则测得的铁含量。(选填"偏低""偏高""不变")
(2)结晶水的测定
将坩埚洗净,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质 量;加热至110℃,恒温一段时间,至于空气中冷却,称量并记录质量;计算结晶水含量。请纠正实验过程中的两处错误;;。
量;加热至110℃,恒温一段时间,至于空气中冷却,称量并记录质量;计算结晶水含量。请纠正实验过程中的两处错误;;。
下面是某学习小组对乙二酸的某些性质进行研究性学习的过程:
【研究课题】探究乙二酸的某些性质
【查阅资料】乙二酸(HOOC-COOH)俗称草酸,其主要物理常数如下:
| 名称 |
乙二酸 |
乙二酸晶体 |
| 分子式 |
H2C2O4 |
H2C2O4·2H2O |
| 颜色状态 |
无色固体 |
无色晶体 |
| 溶解度(g) |
8.6(20℃) |
— |
| 熔点(℃) |
189.5 |
101.5 |
| 密度(g·cm-3) |
1.900 |
1.650 |
又知草酸在100℃时开始升 华,157℃时大量升华,并开始分解。草酸钙不溶于水。根据上述材料提供的信息,回答下列问题:
华,157℃时大量升华,并开始分解。草酸钙不溶于水。根据上述材料提供的信息,回答下列问题:
【提出猜想】
[猜想一]根据草酸晶体的组成对其分解产物进行猜想
[设计方案]
(1)该小组同学猜想其产物为CO、CO2和H2O,并设计了探究实验,实验装置如下(草酸晶体分解装置略)。
限选试剂:澄清石灰水、冰水混合物、碱石灰、氧化铜、无水硫酸铜(已知草酸蒸气也可使澄清石灰水变浑浊,草酸蒸气在低温下可冷凝为固体)。请回答下列问题:
①B装置中所装药品为,
② CO2的检验装置是(填上面装置编号,下同),CO的检验装置是。
③装置A的作用是。
[猜想二]乙二酸具有弱酸性
[设计方案]
(2)该小组同学为验证草酸具有弱酸性设计了下列实验,其中能达到实验目的是(填字母)。
| A.将草酸晶体溶于含酚酞的NaOH溶液中,溶液褪色 |
| B.测定相同浓度的草酸和硫酸溶液的pH |
| C.测定草酸钠(Na2C2O4)溶液的pH |
| D.将草酸溶液加入Na2CO3溶液中,有CO2放出 |
[猜想三]乙二酸具有还原性
[设计方案]
(3)该小组同学向用硫酸酸化的KMnO4溶液中滴入过量的草酸溶液,发现酸性KMnO4溶液褪色,从而判断草酸具有较强的还原性。配平该反应的离子方程式:
MnO4- + H2C2O4 + H+ = Mn2+ + CO2↑+ H2O
(4)利用上述原理可定量测定某草酸晶体样品中H2C2O4·2H2O的含量,方法是:称取该样品0.12 g,加适量水完全溶解,然后用0.020 mol·L-1的酸性KMnO4溶液滴定至终点(杂质不参与反应),滴定前后滴定管中的液面读数如图所示,则该草酸晶体样品中H2C2O4·2H2O的质量分数为。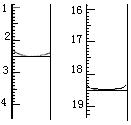
某研究性学习小组设计实验方案制备氯化铜并验证次氯酸的漂白性。
已知氯化铜遇水蒸气潮解。
|
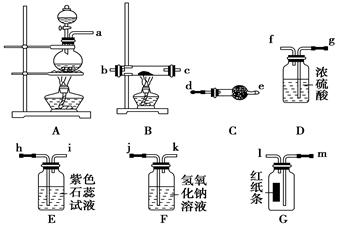
 __________。
__________。
 _。
_。