下面是某学习小组对乙二酸的某些性质进行研究性学习的过程:
【研究课题】探究乙二酸的某些性质
【查阅资料】乙二酸(HOOC-COOH)俗称草酸,其主要物理常数如下:
| 名称 |
乙二酸 |
乙二酸晶体 |
| 分子式 |
H2C2O4 |
H2C2O4·2H2O |
| 颜色状态 |
无色固体 |
无色晶体 |
| 溶解度(g) |
8.6(20℃) |
— |
| 熔点(℃) |
189.5 |
101.5 |
| 密度(g·cm-3) |
1.900 |
1.650 |
又知草酸在100℃时开始升 华,157℃时大量升华,并开始分解。草酸钙不溶于水。根据上述材料提供的信息,回答下列问题:
华,157℃时大量升华,并开始分解。草酸钙不溶于水。根据上述材料提供的信息,回答下列问题:
【提出猜想】
[猜想一]根据草酸晶体的组成对其分解产物进行猜想
[设计方案]
(1)该小组同学猜想其产物为CO、CO2和H2O,并设计了探究实验,实验装置如下(草酸晶体分解装置略)。
限选试剂:澄清石灰水、冰水混合物、碱石灰、氧化铜、无水硫酸铜(已知草酸蒸气也可使澄清石灰水变浑浊,草酸蒸气在低温下可冷凝为固体)。请回答下列问题:
①B装置中所装药品为 ,
② CO2的检验装置是 (填上面装置编号,下同),CO的检验装置是 。
③装置A的作用是 。
[猜想二]乙二酸具有弱酸性
[设计方案]
(2)该小组同学为验证草酸具有弱酸性设计了下列实验,其中能达到实验目的是 (填字母)。
| A.将草酸晶体溶于含酚酞的NaOH溶液中,溶液褪色 |
| B.测定相同浓度的草酸和硫酸溶液的pH |
| C.测定草酸钠(Na2C2O4)溶液的pH |
| D.将草酸溶液加入Na2CO3溶液中,有CO2放出 |
[猜想三]乙二酸具有还原性
[设计方案]
(3)该小组同学向用硫酸酸化的KMnO4溶液中滴入过量的草酸溶液,发现酸性KMnO4溶液褪色,从而判断草酸具有较强的还原性。配平该反应的离子方程式:
MnO4- + H2C2O4 + H+ = Mn2+ + CO2↑+ H2O
(4)利用上述原理可定量测定某草酸晶体样品中H2C2O4·2H2O的含量,方法是:称取该样品0.12 g,加适量水完全溶解,然后用0.020 mol·L-1的酸性KMnO4溶液滴定至终点(杂质不参与反应),滴定前后滴定管中的液面读数如图所示,则该草酸晶体样品中H2C2O4·2H2O的质量分数为 。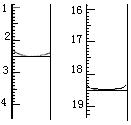
(共14分)某同学设计如下实验装置探究硫酸与金属、非金属的反应、验证其产物,并探究随着反应的进行,硫酸性质发生的变化。根据实验要求回答相关问题:
F装置用于检验二氧化碳。供选择的试剂有:只含碳的生铁、18 mol·L-1的硫酸、品红溶液、无水硫酸铜粉未、酸性高锰酸钾溶液、氧化铜、澄清的石灰水、碱石灰。(供选择的试剂可重复使用)
(1)打开分液漏斗的活塞,A装置中发生的反应6H2SO4(浓)+2Fe Fe2(SO4)3+6H2O↑+3SO2↑和(用化学方程式表示),随反应的进行,硫酸的浓度变稀,又发生反应(用化学方程式表示)。
Fe2(SO4)3+6H2O↑+3SO2↑和(用化学方程式表示),随反应的进行,硫酸的浓度变稀,又发生反应(用化学方程式表示)。
(2)B装置中的试剂是。
(3)E装置中的作用是。
(4)G装置中的试剂是,现象是。
(5)从安全角度考虑,应后点燃的酒精灯(填“A”或“G”)。你认为本实验尾气是否需要处理?(填“是”或“否”),如需处理,具体方案是。
某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
| 时间(min) |
1 |
2 |
3 |
4 |
5 |
| 氢气体积(mL) |
50 |
120 |
232 |
290 |
310 |
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大,原因是。
(2)哪一段时段的反应速率最小,原因是。
(3)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变,要写出计算过程)。
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:你认为可行的是(填编号) 。
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液
溴乙烷是一种重要的有机化工原料,其沸点为38.4℃。制备溴乙烷的一种方法是乙醇与氢溴酸反应.某课外小组欲在实验室制备溴乙烷的装置如图,实验操怍步骤如下: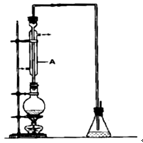
①检查装置的气密性;
②在圆底烧瓶中加入95%乙醇、溴化钠、浓硫酸及几粒碎瓷片;
③小心加热,使其充分反应。
请问答下列问题。
(1)装置A的作用是。
(2)反应结束后,得到的粗产品呈棕黄色(含少量的溴单质)。为了除去粗产品中的杂质,可选择下列试剂中的(填写上正确选项的字母)。
a.亚硫酸钠溶液b.氢氧化钠溶液
c.乙醇d.四氯化碳
该实验操作中所需的主要玻璃仪器是(填仪器名称)。
(3)要进一步制得纯净的溴乙烷,可继续用蒸馏水洗涤,分液后,再加入无水 ,然后进行的实验操作是(填写正确选项的字母)。
,然后进行的实验操作是(填写正确选项的字母)。
a.分液b.蒸馏 c.萃取
(4)为了检验溴乙烷中含有溴元素,通常采用的方法是取少量溴乙烷,然后(按实验的操作顺序选填下列序号)。
①加热 ②加入 溶液③加入稀
溶液③加入稀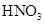 酸化④加入NaOH溶液
酸化④加入NaOH溶液
实验室常用二氧化锰和浓盐酸反应制备氯气,用下图装置可制备纯净、干燥的氯气,并验证其部分性质。
试回答下列问题:
(1)A中发生反应的化学方程式是。
(2)C、D中所用试剂分别是:C;D。
(3)B中出现的现象是。
(4)请用离子方程式表示F中NaOH溶液的作用。
(5)若想制得标准状况下2.24L氯气,理论上被氧化的HCl的物质的量是mol。
某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol・L-1、2.00 mol・L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为20℃、35℃,每次实验HNO3的用量为25.0 mL、大理石用量为10.00 g。
请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验 编号 |
T/℃ |
大理石 规格 |
HNO3浓度 (mol・L-1) |
实验目的 |
| ① |
25 |
粗颗粒 |
2.00 |
(Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和探究温度对该反应速率的影响; (Ⅲ)实验①和探究大理石规格(粗、细)对该反应速率的影响; |
| ② |
||||
| ③ |
粗颗粒 |
2.00 |
||
| ④ |
25 |