溴乙烷是一种重要的有机化工原料,其沸点为38.4℃。制备溴乙烷的一种方法是乙醇与氢溴酸反应.某课外小组欲在实验室制备溴乙烷的装置如图,实验操怍步骤如下: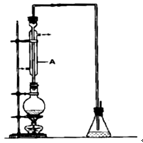
①检查装置的气密性;
②在圆底烧瓶中加入95%乙醇、溴化钠、浓硫酸及几粒碎瓷片;
③小心加热,使其充分反应。
请问答下列问题。
(1)装置A的作用是 。
(2)反应结束后,得到的粗产品呈棕黄色(含少量的溴单质)。为了除去粗产品中的杂质,可选择下列试剂中的 (填写上正确选项的字母)。
a.亚硫酸钠溶液 b.氢氧化钠溶液
c.乙醇 d.四氯化碳
该实验操作中所需的主要玻璃仪器是 (填仪器名称)。
(3)要进一步制得纯净的溴乙烷,可继续用蒸馏水洗涤,分液后,再加入无水 ,然后进行的实验操作是 (填写正确选项的字母)。
,然后进行的实验操作是 (填写正确选项的字母)。
a.分液 b.蒸馏 c.萃取
(4)为了检验溴乙烷中含有溴元素,通常采用的方法是取少量溴乙烷,然后 (按实验的操作顺序选填下列序号)。
①加热 ②加入 溶液 ③加入稀
溶液 ③加入稀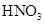 酸化 ④加入NaOH溶液
酸化 ④加入NaOH溶液
三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校化学实验小组通过实验探究某红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4。
设计探究实验:取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂。
(1)若只有Fe2O3,则实验现象是_____________。
(2)若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则此过程中的离子反应为:
____________________________。
(3)经实验分析,确定红色粉末为Cu2O和Fe2O3的混合物。实验小组欲测定Cu2O的质量分数。已知Cu2O在空气中加热生成CuO。
测定流程: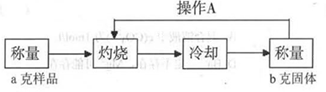
实验中操作A的名称为_____________。
灼烧过程中,所需仪器有:酒精灯、玻璃棒、_____________等(夹持仪器除外)。
(4)写出混合物中Cu2O的质量分数的表达式_____________。
实验小组欲利用红色粉末制取较纯净的胆矾(CuSO4•5H2O)。经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下: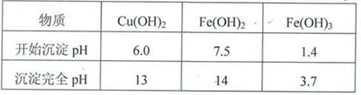
实验室有下列试剂可供选择:
| A.氯水 | B.H2O2 | C.NaOH | D.Cu2(OH)2CO3 |
实验小组设计如下实验方案制取胆矾: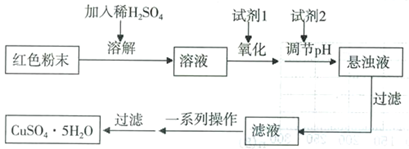
(5)用试剂编号表示:试剂l为_____________,试剂2为_____________。
(6)为什么先“氧化”后“调节pH”?pH控制范围为多少?__________________________________
某校化学小组的同学将一批废弃的线路板简单处理后,得到含Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计了如下制备硫酸铜和硫酸铝晶体的方案:
回答下列问题:
(1)第①步参加反应的金属有种。
(2)第②步加入H2O2是因为滤液1中含有离子。使用H2O2的优点是。
(3) 用第③步所得CuSO4·5H2O制备无水硫酸铜的方法是:。
(4)请帮助化学小组的同学完成由滤渣2制取Al2(SO4)3·18H2O 的实验步骤:
①取滤渣2,加入足量的 ,充分反应后过滤;
②取滤液,加入足量的(填写试剂的化学式),然后(填写所需实验操作的名称);
(3)用适量稀硫酸溶解;
(4)最后经过(填写所需实验操作的名称),获得Al2(SO4)3·18H2O晶体。
(1)第③步所得CuSO4·5H2O含有可溶性杂质Na2SO4。为了用重量法测定CuSO4·5H2O的纯度,选用BaCl2(aq)和其他必要的试剂,请列出必须测定的物理量。
为了探究SO2与Na2O2的反应是否类似于CO2,甲同学设计了如图实验装置。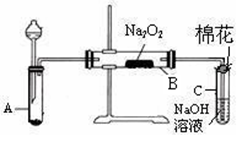
回答下列问题:
(1)制取SO2的合适试剂是 。
a.80%的H2SO4(aq)b.10%的H2SO4(aq)
c.Na2SO3(s)d.Na2SO3(aq)
(1)装置C中NaOH(aq)的作用是。
(1)移开棉花,将带火星的木条放在C试管口,未见木条复燃。甲同学因此认为SO2与Na2O2的反应不同于CO2。请按甲同学的观点写出反应的化学方程式。
(1)检验反应后B装置中生成物的方法是。
(1)乙同学认为无论反应原理如何,最终都有O2产生。乙同学的理由是。按照乙同学的观点,该装置还需作如下改进:。(简要阐述,并指明必需的装置名称与试剂。)
对实验过程中出现的异常现象进行探究,是实施素质教育、培养创新精神的有效途经。
【实验1】用下图实验装置进行铜与浓硫酸的反应,实验中发现试管内除了产生白色硫酸铜固体外,在铜丝表面还有黑色固体甲生成,甲中可能含有黑色的CuO、CuS、Cu2S。查阅资料:CuS和Cu2S均为黑色固体,常温下都不溶于稀盐酸,在空气中煅烧,均转化为CuO和SO2。为了探究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如下实验:

(1)上述实验装置除了有尾气吸收装置外,还有一个显著的优点是。
(2)固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有。
(3)确定乙是否煅烧完全的操作是。
(4)煅烧过程中一定发生的化学反应方程式为。
【实验2】某化学兴趣小组设计了如下实验装置(尾气吸收装置未画出),探究Cl2、Br2、Fe3+的氧化性强弱。
(5)根据下列实验操作和现象,填写实验结论。
| 实验操作 |
实验现象 |
结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯。 |
D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,CCl4层无明显变化。 |
Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: |
(6)因忙于观察和记录,没有及时停止反应,D、E中均发生了异常的变化:D装置中,红色慢慢褪去;E装置中,CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
| ⅰ.(SCN)2性质与卤素单质类似。氧化性:Cl2>(SCN)2。 ⅱ.Cl2和Br2反应生成的BrCl呈红色,沸点约5℃,与水发生水解反应。 ⅲ.AgClO、AgBrO均可溶于水。 |
①请用平衡移动原理(结合化学用语)解释Cl2过量时D中溶液红色褪去的原因____;
请设计简单实验证明上述解释。
②欲探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合化学用语解释仅产生白色沉淀的原因。
精制氯化钾在工业上可用于制备各种含钾的化合物。完成下列填空:
(1)工业氯化钾中含有Fe3+、SO42—、Br—等杂质离子,可按如下步骤进行精制,完成各步内容。
①溶解;②加入试剂至Fe3+、SO42—沉淀完全,煮沸;③_____________________;④加入盐酸调节pH;
⑤___________________(除Br—);⑥蒸干灼烧。
步骤②中,依次加入的沉淀剂是NH3·H2O、________、________。
证明Fe3+已沉淀完全的操作是_________________________________________________。
(2)有人尝试用工业制纯碱原理来制备K2CO3。他向饱和KCl溶液中依次通入足量的______和______两种气体,充分反应后有白色晶体析出。将得到的白色晶体洗涤后灼烧,结果无任何固体残留,且产生的气体能使澄清石灰水变浑浊。
写出生成白色晶体的化学方程式:___________________________________________。
分析该方法得不到K2CO3的原因可能是_______________________________________。
(3) 用氯化钾制备氢氧化钾的常用方法是离子交换膜电解法。氢氧化钾在_________极区产生。为了避免两极产物间发生副反应,位于电解槽中间的离子交换膜应阻止_______(填“阴”、“阳”或“所有”)离子通过。
(4)科学家最近开发了一种用氯化钾制氢氧化钾的方法。其反应可分为5步(若干步已合并,条件均省略)。请写出第⑤步反应的化学方程式。
第①、②步(合并):2KCl + 4HNO3→ 2KNO3 + Cl2 + 2NO2 + 2H2O
第③、④步(合并):4KNO3 + 2H2O → 4KOH + 4NO2 + O2
第⑤步:____________________________________________
总反应:4KCl + O2 + 2H2O → 4KOH + 2Cl2
与电解法相比,该方法的优势可能是______________。