某校兴趣小组同学欲研究SO2的性质。
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是 。
| 第1组 |
第2组 |
第3组 |
| S(单质) |
SO2、X、Na2SO3、NaHSO3 |
SO3、H2SO4、Na2SO4、NaHSO4 |
(2)利用下图所示的装置研究SO2的性质:
(熔点:SO2 -76.1℃,SO3 16.8℃;沸点:SO3 -10℃,SO3 44.8℃)
①装置I模拟工业生产中SO2催化氧化的反应,其化学方程式是 。
②甲同学按I、II、III、IV的顺序连接装置,装置II的作用是 ;装置III中溶液逐渐褪色,生成Mn2+,同时pH降低,则该反应的离子方程式是 。
③乙同学按I、II、IV的顺序连接装置,若装置IV中有40 mL 2.5 mol?L-1 NaOH溶液,反应后增重4.8 g,则装置IV中发生反应的总化学方程式是 。
硫酸亚铁是一种重要的工业原料,实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备绿矾(FeSO4·7H2O)晶体,工艺流程如下所示:
(1)将过程③中的产生的气体通入下列溶液中,溶液不会褪色的是__________;
| A.品红溶液 | B.红色的酚酞试液 |
| C.酸性KMnO4溶液 | D.紫色石蕊溶液 |
(2)Z是_____,此时溶液X中发生反应的离子方程式为_____________________________。
(3)检验溶液Y中含有金属阳离子的实验方法是______________________。
(4)操作Ⅲ、Ⅳ等实验操作步骤为蒸发、冷却结晶、 (填操作名称)、洗涤。
如下图所示,蒸发操作中的一处错误是 。
(5)测定绿矾产品中Fe2+含量的实验步骤:
a.称取6.0产品,溶解,在250mL容量瓶中定容;
b.量取25mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01mol•L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积为40mL(滴定时发生反应的离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)。
①计算上述产品中FeSO4•7H2O的质量分数为________;
②若用上述方法测定的产品中FeSO4•7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有___________(只回答一条即可)。
(15分)肼是重要的化工原料。某探究小组利用下列反应制取水合肼(N2H4·H20)。
CO(NH2)+2NaOH+NaCl0=Na2C03+N2H4·H20+NaCI
实验一:制备NaClO溶液。(实验装置如图所示).
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外,还有_______________(填标号)。
A.容量瓶B.烧杯C.烧瓶 D.玻璃棒
(2)锥形瓶中发生反应的化学方程式是_________________________。
(3)因后续实验需要,需利用中和滴定原理测定反应后锥形瓶中混合溶液的NaOH的浓度。请选用所提供的试剂,设计实验方案。提供的试剂:H202溶液、FeCl2溶液、0.1000mol·L-1盐酸、甲基橙试液
_________________________________________.
实验二:制取水合肼。(实验装置如图所示)
控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。
加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分。
(己知:N2H4·H20+2NaClO=N2↑+3H20+2NaCl)
(4)分液漏斗中的溶液是_____________________(填标号)。
A.CO(NH2)2溶液
B.NaOH和NaClO混合溶液
选择的理由是____________________________________________。
实验三:测定馏分中肼含量。
称取馏分5.000g,加入适量NaHC03固体,加水配成250 mL溶液,移出25.00 mL,用0.1000mol·L-1的I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右。
(己知:N2H4·H20+2I2=N2↑+4HI+H20)
(5)滴定过程中,NaHC03能控制溶液的pH在6.5左右,原因是_____________________。
(6)实验测得消耗I2溶液的平均值为1 6.00mL,馏分中水合肼(N2H4·H20)的质量分数为______________。
氢化锂(LiH)在干燥的空气中能稳定存在,遇水或酸能够引起燃烧。某活动小组准备使用下列装置制备LiH固体。
甲同学的实验方案如下:
(1)仪器的组装连接:上述仪器装置接口的连接顺序为_________________,加入药品前首先要进行的实验操作是_______________(不必写出具体的操作方法);其中装置B的作用是_____________________。
(2)添加药品:用镊子从试剂瓶中取出一定量金属锂(固体石蜡密封),然后在甲苯中浸洗数次,该操作的目的是________________________________________,然后快速把锂放入到石英管中。
(3)通入一段时间氢气后加热石英管,在加热D处的石英管之前,必须进行的实验操作是
______________________________________________________________________。
(4)加热一段时间后停止加热,继续通氢气冷却,然后取出LiH,装入氮封的瓶里,保存于暗处。采取上述操作的目的是为了避免LiH与空气中的水蒸气接触而发生危险。(反应方程式:LiH + H2O =" LiOH" + H2↑),分析该反应原理,完成LiH与无水乙醇反应的化学方程式_____________________。
(5)准确称量制得的产品0.174g,在一定条件下与足量水反应后,共收集到气体470.4 mL(已换算成标准状况),则产品中LiH与Li的物质的量之比为____________________。
(6)乙同学对甲的实验方案提出质疑,他认为未反应的H2不能直接排放,所以在最后连接了装置E用来收集H2,请将E装置补充完整。
(14分)以铬铁矿(主要成分为FeO和Cr2O3 ,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(红矾钠的主要成分为重铬酸钠:Na2Cr2O7·2H2O),其主要工艺流程如下:
查阅资料得知:
i.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42-。
ii.
| 物质 |
开始沉淀的pH值 |
完全沉淀的pH值 |
| Fe(OH)3 |
2.7 |
3.7 |
| Al(OH)3 |
3.4 |
4.4 |
| Cr (OH)3 |
4.6 |
5.9 |
| Fe(OH)2 |
7.5 |
9.7 |
| Bi(OH)3 |
0.7 |
4.5 |
回答下列问题:
(1)反应之前先将矿石粉碎的目的是。
(2)操作I、III、IV用到的主要玻璃仪器有玻璃棒和__________(填仪器名称)。
(3)写出④反应的离子反应方程式。
(4)⑤中酸化是使CrO42-转化为Cr2O72-,写出该反应的离子方程式。
(5)将溶液H经过下列操作,蒸发浓缩,__________,过滤,洗涤,干燥即得红矾钠。
(6)取一定质量的固体D溶解于200mL的硫酸中,向所得溶液中加入5mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V关系如图所示,则硫酸的浓度为,固体D中含Fe化合物的物质的量为。
(14分)已知三氯化铁的熔点为306℃,沸点为315℃,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。某学习小组的同学对氯气与铁的反应及产物做了如下探究实验:
(1)装置的连接顺序为。
(2)饱和食盐水的作用是。
(3)反应一段时间后熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验: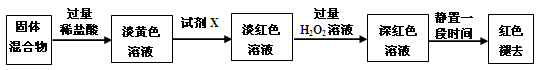
①淡黄色溶液中加入试剂X生成淡红色溶液的离子反应方程式为_______。
②淡红色溶液中加入过量H2O2后溶液红色加深的原因是。
(4)已知红色褪去的同时有气体生成,经检验为O2。该小组同学对红色褪去的原因进行探究。
①取褪色后溶液三份,第一份滴加FeCl3溶液无明显变化;第二份滴加试剂X,溶液出现红色;第三份滴加稀HCl和BaCl2溶液,产生白色沉淀。
②另取同浓度的FeCl3溶液滴加2滴试剂X,溶液变红,再通入O2,无明显变化。
实验①说明;
实验②的目的是;
得出结论:溶液褪色的原因是。