将6.4 g铜与足量的浓硫酸在加热情况下充分反应,铜没有剩余。试计算:(要求有计算过程)
(1)生成的SO2的体积(标准状况下)。
(2)若用4 mol·L-1的NaOH溶液吸收生成的SO2 ,恰好生成Na2SO3 ,计算需要NaOH溶液的体积。
称取63.2 g KMnO4固体,先加热分解制取一定量的O2,再将剩余固体和足量36.5%的浓盐酸( )混合加热制取Cl2。设收集到的O2为
)混合加热制取Cl2。设收集到的O2为 mol,收集到的Cl2为
mol,收集到的Cl2为 mol,最后Mn元素全部以Mn2+的形式存在于溶液中。
mol,最后Mn元素全部以Mn2+的形式存在于溶液中。
(1)如果配制上述500 mL浓盐酸,则需标准状况下HCl气体的体积为L。
(2)当 =0.16时,收集到Cl2的物质的量为。
=0.16时,收集到Cl2的物质的量为。
在标准状况下,1体积水溶解700体积氨气,所得溶液密度为0.9g·cm-3,这种氨水的物质的量浓度和溶质的质量分数分别为多少?
已知:(1)Fe2O3(s) + 3CO(g) ="=" 2Fe(s) + 3CO2(g)△H1= -26.7 kJ/mol
(2)3Fe2O3(s) + CO(g) ="=" 2Fe3O4(s) + CO2(g)△H2= -50.75 kJ/mol
(3) Fe3O4(s) + CO(g) ="=" 3FeO(s) + CO2(g)△H3= -36.5 kJ/mol
计算反应:2FeO(s) + 2CO(g) ="=" 2Fe(s) + 2CO2(g)的△H(要有计算过程)。
黄铁矿主要成分是FeS2。某硫酸厂在进行黄铁矿成分测定时,取0.1000 g样品在空气中充分灼烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000 mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL 。
已知:SO2 + 2Fe3+ + 2H2O ="=" SO2- + 2Fe2+ + 4H+
Cr2O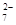 + 6 Fe2+ + 14 H+ ="=" 2 Cr3+ + 6 Fe3+ + 7 H2O
+ 6 Fe2+ + 14 H+ ="=" 2 Cr3+ + 6 Fe3+ + 7 H2O
⑴.样品中FeS2的质量分数是(假设杂质不参加反应)________________。
⑵.若灼烧6 g FeS2产生的SO2全部转化为SO3气体时放出9.83 kJ热量,产生的SO3与水全部化合生成H2SO4,放出13.03 kJ热量,写出SO3气体转化为H2SO4的热化学方程式:____________________________________。
⑶.煅烧10 t上述黄铁矿,理论上产生SO2的体积(标准状况)为_______________L,制得98%的硫酸质量为__________ t ,SO2全部转化为H2SO4时放出的热量是_______ kJ。
今有Na2CO3、NaHCO3、NaCl组成的混合物100g,加热到质量不再减少为止。剩余残渣为84.5g,将残渣溶于水,滴入足量的AgNO3溶液得到白色沉淀,加足量的稀硝酸后大部分沉淀消失,剩余沉淀为12.26g,试计算混合物中Na2CO3、NaHCO3、和NaCl的质量分数各是多少?