已知黄钠铁矾[NaxFey(SO4)m(OH)n]具有沉淀颗粒大、沉淀速率快、容易过滤等特点。某研究小组先将某废水中Fe2+氧化为Fe3+,再加入Na2SO4使其生成黄钠铁矾而除去。该小组为测定黄钠铁矾的组成,进行了如下实验:
①称取4.850 g样品,加盐酸完全溶解后,配成100.00 mL溶液A;
②量取25.00 mL溶液A,加入足量的KI,用0.2500 mol·L-1Na2S2O3溶液进行滴定(反应为I2+2Na2S2O3=2NaI+Na2S4O6),消耗30.00 mLNa2S2O3溶液至终点。
③另取25.00 mL溶液A,加足量BaCl2溶液充分反应后,过滤、洗涤、干燥后得沉淀1.165 g。
(1)该小组不采用生成Fe(OH)3沉淀的方法除去铁元素,是因为生成的Fe(OH)3 。
(2)用Na2S2O3溶液进行滴定时,使用的指示剂为 ,滴定到终点的颜色变化为 。
(3)通过计算确定黄钠铁矾的化学式(写出计算过程)。
环己烷可制备1,4-环己二醇,下列七步有关反应(其中无机产物都已经略去)中,其中有两步属于取代反应,两步属于消去反应,三步属于加成反应,试回答:
(1)写出下列化合物的结构简式:
A:C:
(2)写出①、④的化学方程式:
①:;
④:。
(15分)某铜矿石的成分中含有Cu2O,还含有少量的Al2O3、Fe203和Si02。某工厂利用此矿石炼制精铜的工艺流程示意图如下:
已知:CuO2+2H+=Cu+Cu2++H2O
(1)滤液A中铁元素的存在形式为(填离子符号),生成该离子的离子方程式为,检验滤液A中存在该离子的试剂为(填试剂名称)。
(2)金属E与固体F发生的某一反应可用于焊接钢轨,该反应的化学方程式为。
(3)常温下.等pH的NaAlO2和NaOH两份溶液中,由水电离出的c(OH一)前者为后者的108倍,则两种溶液的pH= 。
(4)将Na2CO3溶液滴入到一定量的CuCl2溶液中,除得到蓝色沉淀,还有无色无味气体放出,写出相应的离子方程式:。
(5)①粗铜的电解精炼如图所示。在粗铜的电解精炼过程中,c为粗铜板,则a端应连接电源的(填“正”或“负”)极,若粗铜中含有Au、Ag、Fe杂质,则电解过程中c电极上发生反应的方程式有、。
②可用酸性高锰酸钾溶液滴定法测定反应后电解液中铁元素的含量。滴定时不能用碱式滴定管盛放酸性高锰酸钾溶液的原因是、滴定中发生反应的离子方程式为,滴定时.锥形瓶中的溶液接触空气,则测得铁元素的含量会(填“偏高”或“偏低”)。
(原创)三聚氰胺(化学式:C3N6H6)是一种重要有机化工原料。下图是我国科技工作者研制的以尿素为原料生产三聚氰胺的工艺——“常压气相一步法联产纯碱新技术”:
已知:以尿素为原料生产三聚氰胺的原理是:6 CO(NH2)2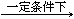 C3N6H6 +6 NH3+3CO2
C3N6H6 +6 NH3+3CO2
请回答:
(1)尿素的结构式为
(2)已知:产品1是本工艺的主产品,产品2是副产品,X为循环使用的物质,产品3为纯碱。写出各主要成份的化学式:产品1产品2X
(3)联氨系统沉淀池中发生的化学反应方程式为:
(4)为了使母液中析出更多的产品2 ,常用的方法是
| A.加入固体NaCl | B.加入固体NaHCO3 |
| C.通入CO2气体 | D.通入NH3 |
(5)若生产过程中有4%的尿素损耗,每吨尿素理论上可得副产品纯碱吨(精确到0.001)
CuSO4溶液与K2C2O4溶液混合反应,产物之一是只含一种阴离子的蓝色钾盐水合物。通过下述实验确定该晶体的组成。
步骤a:称取0.672 0 g样品,放入锥形瓶,加入适量2 mol·L-1稀硫酸,微热使样品溶解。再加入30 mL水加热,用0.200 0 mol·L-1 KMnO4溶液滴定至终点,消耗8.00 mL。
步骤b:接着将溶液充分加热,使淡紫红色消失,溶液最终呈现蓝色。冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI。用0.250 0 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗8.00 mL。
已知涉及的部分离子方程式如下:
步骤a:2 MnO4-+5C2O42-+16H+= 2Mn2++8H2O+10CO2↑
步骤b:2Cu2++4I-= 2CuI↓+I2 I2+2S2O32-= 2I-+S4O62-
(1)已知室温下CuI的Ksp=1.27×10-12,欲使溶液中c(Cu+)≤1.0×10-6 mol·L-1,应保持溶液中
c(I-)≥mol·L-1。
(2)MnO4-在酸性条件下,加热能分解为O2;同时生成Mn2+。该反应的离子方程式为;若无该操作,则测定的Cu2+的含量将会(填“偏高”、“偏低”或“不变”)。
(3)步骤b用淀粉溶液作指示剂,则滴定终点观察到的现象为。
(4)通过计算确定样品晶体的组成。
【化学—化学与技术】选考海洋是一个丰富的资源宝库,通过海水的综合利用可获得许多物质供人类使用。
(1)海水中盐的开发利用:
①海水制盐目前以盐田法为主,建盐田必须选在远离江河入海口,多风少雨,潮汐落差大且又平坦空旷的海滩。所建盐田分为贮水池、池和结晶池。
②工业上通常以NaCl 、CO2和 NH3为原料制取纯碱,请写出第一步制取NaHCO3的化学方程式。
(2)电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如图所示。其中具有选择性的阴离子交换膜和阳离子交换膜相间排列。请回答下面的问题: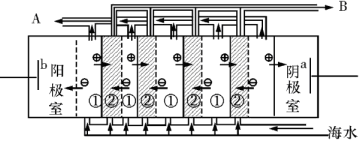
Ⅰ.电渗析法淡化海水中阴极室可获得的重要化工原料有。
II.上图中虚线部分表示离子交换膜。 淡水从(A或B)排出。
(3)用苦卤(含Na+、K+、Mg2+、Cl-、Br-等离子)可提取溴,其生产流程如下: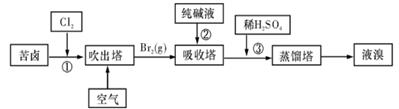
Ⅰ.写出反应③的离子方程式为。
II.通过①氯化已获得含Br2的溶液,为何还需经过吹出、吸收、酸化来重新获得含Br2的溶液?。
Ⅲ.向蒸馏塔中通入水蒸气加热,控制温度在90℃左右进行蒸馏的原因是。