【化学—化学与技术】选考海洋是一个丰富的资源宝库,通过海水的综合利用可获得许多物质供人类使用。
(1)海水中盐的开发利用:
①海水制盐目前以盐田法为主,建盐田必须选在远离江河入海口,多风少雨,潮汐落差大且又平坦空旷的海滩。所建盐田分为贮水池、 池和结晶池。
②工业上通常以NaCl 、CO2和 NH3为原料制取纯碱,请写出第一步制取NaHCO3的化学方程式 。
(2)电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如图所示。其中具有选择性的阴离子交换膜和阳离子交换膜相间排列。请回答下面的问题: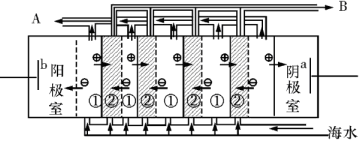
Ⅰ.电渗析法淡化海水中阴极室可获得的重要化工原料有 。
II.上图中虚线部分表示 离子交换膜。 淡水从 (A或B)排出。
(3)用苦卤(含Na+、K+、Mg2+、Cl-、Br-等离子)可提取溴,其生产流程如下: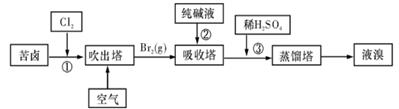
Ⅰ.写出反应③的离子方程式为 。
II.通过①氯化已获得含Br2的溶液,为何还需经过吹出、吸收、酸化来重新获得含Br2的溶液? 。
Ⅲ.向蒸馏塔中通入水蒸气加热,控制温度在90℃左右进行蒸馏的原因是 。
物质A ~ G有下图所示转化关系部分反应物、生成物未列出)。其中A为某金属矿的主要成分,经过一系列反应可得到气体B和固体C。单质C可与E的浓溶液发生反应,G为砖红色沉淀。
请回答下列问题:
(1)写出下列物质的化学式:B___________、G___________。
(2)反应②的化学方程式是__________________________________________________。
(3)利用电解可提纯C物质,现以碱性锌锰电池为外电源,在该电解反应中电解质溶液是_______________,阳极物质是______________。MnO2是碱性锌锰电池的正极材料,电池放电时,正极的电极反应式为_____________________________________________。
(4)将0.20 mol B和0.10 mol O2充入一个固定容积为5 L的密闭容器中,在一定温度并有催化剂存在下,进行反应①,经半分钟后达到平衡,测得容器中含D 0.18 mol,则vO(2)== ______________mol/L·min);若温度不变,继续通入0.20 mol B和0.10 mol O2,则平衡________________移动填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,________mol < nD) < ________mol。
(5)写出F G转化过程中,甲醛参与反应的化学方程式:_______________________________。
G转化过程中,甲醛参与反应的化学方程式:_______________________________。
目前,“低碳经济”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: 它所对应的化学反应为:。
它所对应的化学反应为:。
(2)—定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器中,发生(1)中反应:其相关数据如下表所示:
| 容器 |
容积/L |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
|
| C(s) |
H2O(g) |
H2(g) |
||||
| 甲 |
2 |
T1 |
2 |
4 |
3.2 |
8 |
| 乙 |
1 |
T2 |
1 |
2 |
1.2 |
3 |
①T1℃时,该反应的平衡常数K=
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度(填选项字母)。
A.=0.8mol·L-1B.=1.4mol·L-1
C.<1.4mol·L-1D.>1.4mol·L-1
③丙容器的容积为1L,T1℃时,按下列配比充入C(s)、H2O(g)、CO2(g)和H2(g), 达到平衡时各气体的体积分数与甲容器完全相同的是(填选项字母)。
A.0.6mol1.0mol0.5mol1.0mol
B.0.6mol2.0mol0mol0mol
C.1.0mol2.0mol1.0mol2.0mol
D.0.25mol0.5mol0.75mol1.5mol
(3)将燃煤废气中的CO2转化为甲醚的反应原理为:
2CO2(g) + 6H2(g) CH3OCH3(g) + 3H2O(g)
CH3OCH3(g) + 3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
| 投料比[n(H2) / n(CO2)] |
500 K |
600 K |
700 K |
800 K |
| 1.5 |
45% |
33% |
20% |
12% |
| 2.0 |
60% |
43% |
28% |
15% |
| 3.0 |
83% |
62% |
37% |
22% |
①该反应的焓变△H0,熵变△S0(填>、<或=)。
②用甲醚作为燃料电池原料,在碱性介质中该电池负极的电极反应式。
若以1.12 L·min-1(标准状况)的速率向该电池中通入甲醚(沸点为-24.9 ℃),用该电池电解500 mL 2 mol·L-1 CuSO4溶液,通电0.50 min后,理论上可析出金属铜g。
CO2和CH4是两种重要的温室气体.通过CH4和CO2反应可以制造价值更高的化学品。
(1)25℃时.以镍合金为催化剂,向4L容器中通人6 mol CO2,4mol CH4,发生反应:
CO2(g)+CH4(g)  2CO(g)+2H2(g)平衡体系中各组分的浓度为:
2CO(g)+2H2(g)平衡体系中各组分的浓度为:
①在该条件下达平衡时,CH4的转化率为____________.
②已知①CH4(g)+2O2(g)=CO2(g)+2H2O (g)ΔH= -890.3KJ/mol
②CO(g)+H2O(g)=CO2(g)+H2(g)ΔH= +2.8KJ/mol
③2CO(g)+O2(g)=2CO2(g)ΔH= -566.0KJ/mol
求反应CO2(g)+ CH4(g) 2CO(g) +2H2(g)的ΔH=___________KJ/mol
2CO(g) +2H2(g)的ΔH=___________KJ/mol
(2)用Cu2Al2O4做催化剂,一定条件下发生反应:CO2+CH4(g) CH3COOH温度与催化剂的催化效率和乙酸的生成速率如图,请回答下列问题:
CH3COOH温度与催化剂的催化效率和乙酸的生成速率如图,请回答下列问题:
①250-3000C时,温度升高而乙酸的生成速率降低的原因是。
②为提高上述反应CH4的转化率,可采取的措施有(写2条)。
(3)Li4SiO4可用于吸收、释放CO2,原理是,5000C时CO2与Li2SiO4接触生成Li2CO3;平衡后加热至7000C ,反应逆向进行,放出CO2,Li4SiO4再生,将该原理用化学方程式表示(请注明正反应方向和逆反应方向的条件):。
(4)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物.多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如下图所示:
①根据下表数据,请你判断该电池工作的适宜温度应控制在范围内(填字母序号)。
②放电时电极A为极。
③充电时,总反应为Na2Sx="2Na+xS" (3<x<5).则阳极的电极反应式为。
【化学—选修5:有机化学基础】β-拉帕醌(β-lapachone)是一种抗癌新药,合成路线如下:
(1)已知X的分子式为C5H9Cl,则X的结构简式为:__________________
(2)有机物B的官能团为:__________________(填名称)
(3)上述反应中,原子利用率达100%的是( ) (选填:“A→B”、“B→C”、“D→E”、“E→F”).
(4)D→E发生的是取代反应,还有一种副产物与E互为同分异构体,且属于醚类,该物质的结构简式为:______________________________.
(5)化合物B的同分异构体很多,满足下列条件的同分异构体数目有_________种(不包括立体异构).
①苯环上有两个取代基;
②分子中有一个醛基和一个羧基;
③分子中只含有一个手性碳原子
(6)已知:双烯合成反应:
由2-甲基-1,3-丁二烯和乙烯为原料(无机试剂及催化剂任用)合成高分子 。
。
请写出下面两个反应方程式:
2-甲基-1,3-丁二烯与乙烯:_____________________________________________________。
生成高分子 :______________________________________________。
:______________________________________________。
(15分)【化学—选修化学与技术】印尼火山喷发不仅带来壮观的美景,还给附近的居民带来物质财富,有许多居民冒着生命危险在底部的火山口收集纯硫磺块来赚取丰厚收入。硫磺可用于生产化工原料硫酸。某工厂用下图所示的工艺流程生产硫酸: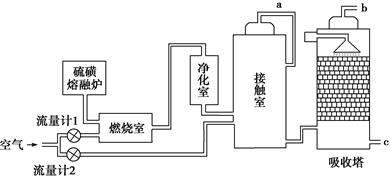
请回答下列问题:
(1)为充分利用反应放出的热量,接触室中应安装______________(填设备名称)。吸收塔中填充有许多瓷管,其作用是_____________________________________________。
(2)为使硫磺充分燃烧,经流量计1通入燃烧室的氧气过量50%,为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计1和流量计2的空气体积比应为________。假设接触室中SO2的转化率为95%,b管排出的尾气中二氧化硫的体积分数为__________(空气中氧气的体积分数按0.2计),该尾气的处理方法是________。
(3)与以硫铁矿为原料的生产工艺相比,该工艺的特点是________(可多选)。
A.耗氧量减少B.二氧化硫的转化率提高
C.产生的废渣减少 D.不需要使用催化剂
(4)硫酸的用途非常广,可应用于下列哪些方面__________________________。
A.橡胶的硫化 B.表面活性剂“烷基苯磺酸钠”的合成
C.铅蓄电池的生产 D.过磷酸钙的制备
(5)矿物燃料的燃烧是产生大气中SO2的主要原因之一。在燃煤中加入适量的石灰石,可有效减少煤燃烧时SO2的排放,请写出此脱硫过程中反应的化学方程式______________________________。