某芳香烃X(相对分子质量为92)是一种重要的有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。其中A是一氯代物,H是一种功能高分子材料。
已知: (苯胺,易被氧化)
(苯胺,易被氧化)
(1)X的结构简式: ,反应⑤的类型: 。
(2)E中官能团的名称: 。
(3)反应②③两步能否互换 ,(填“能”或“不能”)理由是: 。
(4)反应④的化学方程式是: 。
(5)写出同时满足下列条件的阿司匹林的一种同分异构体的结构简式: 。
①苯环上一卤代物只有2种;
②能发生银镜反应,分子中无甲基;
③1mol该物质最多能与3molNaOH反应。
(6)根据已有知识并结合相关信息,写出以A为原料制备 的合成路线流程图(无机试剂任用)。合成路线流程图示例如: 。
的合成路线流程图(无机试剂任用)。合成路线流程图示例如: 。
已知H2CO3的Ka1=4.2×10-7、Ka2=5.6×10-11;HClO的Ka="3.0×" 10-8,
HF的Ka=3.5×10-4。
(1)NaClO溶液中通入少量CO2发生反应的离子方程式为 。
(2)在饱和氯水中加入NaHCO3,直至溶液的黄绿色褪去,则发生反应的离子方程式为 。
(3)常温下,将pH和体积都相同的氢氟酸和次氯酸分别加蒸馏水稀释,pH随溶液体积变化如图所示。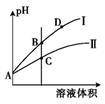
①曲线Ⅰ为 稀释时pH的变化曲线。
②取A点的两种酸溶液,中和相同体积、相同浓度的NaOH溶液,消耗 体积较小。
(4)25 ℃时,将0.40 mol·L-1 HCN溶液与0.20 mol·L-1 NaOH溶液各100 mL混合后,测得溶液的pH=a(a>7)。则该溶液中所有离子浓度大小关系为 ;
c(HCN)-c(CN-)= mol·L-1。(假设混合后体积等于两种溶液体积之和)
人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注。
(1)工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下: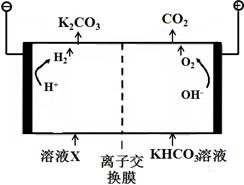
在阳极区发生的反应包括 和H ++ HCO3- ="==" H2O + CO2↑。
简述CO32-在阴极区再生的原理 。
(2)再生装置中产生的CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇。
已知:25 ℃,101 KPa下:
H2(g) + 1/2 O2(g) ="==" H2O(g)ΔH1=" -242" kJ/mol
CH3OH(g) + 3/2 O2(g) ="==" CO2 (g) + 2 H2O(g)ΔH2=" -676" kJ/mol
① 写出CO2和H2生成气态甲醇等产物的热化学方程式 。
② 下面表示合成甲醇的反应的能量变化示意图,其中正确的是 (填字母序号)。
(3)在密闭的再生装置中,加入5 mol H2与2 mol CO2发生反应生成甲醇,反应达到平衡时,改变温度(T)和压强(P),反应混合物中甲醇(CH3OH)的物质的量分数变化情况如下图所示,下列说法正确的是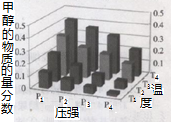
| A.P1> P2> P3>P4 |
| B.甲醇的物质的量分数越高,反应的平衡常数越大 |
| C.图示中,该反应的温度变化为:T1> T2> T3>T4 |
| D.T4、P4、时,H2的平衡转化率为60% |
(4)已知某种甲醇燃料电池中,电解质溶液为酸性,示意图如下:工作结束后,B电极室溶液的pH与工作前相比将 (填写“增大”、“减小”或“不变”,溶液体积变化忽略不计)。A电极附近甲醇发生的电极反应式为 。
《化学与生活》
(1)下列常用物质: A 碳酸氢钠B 阿斯匹林 C 葡萄糖 D 苯甲酸钠 E 柠檬黄
请用字母填空:
具有解热镇痛疗效的是 ,可直接进入人体血液补充能量的是 ,可用作食品防腐剂的是 ,常用作食品着色剂的是 ,常用作治疗胃酸过多的抗酸剂的是 。
(2)2012年世界青年奥运会将在南京举办。保护环境,人人有责。
①空气质量监测中,不需要监测物质的浓度指标是 ,形成酸雨的物质是 。
| A.可吸入颗粒物的含量 | B.NO2 | C.SO2 | D.CO2 |
② 在处理产生的废水时,需先加入明矾,其作用是 ;后通入氯气或二氧化氯,其作用是 。
③汽车尾气需要用催化转化器减少有毒气体排放。汽车尾气中CO、NO在催化剂作用下生成可参与大 气循环的两种气体,请写出其反应方程式 。
④对垃圾需要分类处理。右图所示的垃圾分类标志的含义是 。
(3)我们穿的衣服通常是由纤维织成的,常见的纤维有棉花、羊毛、涤纶等。用灼烧法可初步鉴别三种纤维,给三种纤维编号后,分别灼烧产生的气味如下:
| 纤维编号 |
① |
② |
③ |
| 灼烧时的气味 |
特殊气味 |
烧纸气味 |
烧焦羽毛气味 |
则羊毛的编号为_____,棉花的编号为_______,涤纶的编号为_______。
下面是关于药物华素片(西地碘片)使用说明书中的部分内容:
| 华素片(西地碘片)使用说明书 [品名和组成] 品名:西地碘片商品名:华素片英文名:Gydiodine Tablets 华素片(西地碘片)的主要活性成分是分子碘,含量1.5mg/片,将碘利用分子分散技术制成分子态西地碘,并含适量的薄荷脑等。 [贮藏] 遮光、密闭、在阴凉处保存。 [有效期] 二年 |
(1)根据上述说明和所学的化学知识回答:
①华素片中含有的活性成分是 (写分子式)
②请推断华素片 (“是”或“不是”)白色
(2)某学生为验证华素片中确实含有上述成分,完成实验如下。请填空:
①取一小粒药片放入研钵中研细,将药粉装入试管并加入约2mL蒸馏水,再向该试管中加入约2mL
(填选项字母),并用力振荡;
A.酒精 B.热裂汽油 C.四氯化碳 D.甘油
②描述加入该液体后可能观察到的现象是 。
某有机物的化学式为 C2H4O2,能与碳酸钠反应放出二氧化碳,则该有机物的结构简式是为 ,官能团的名称是_ _。