能源的开发、利用与人类社会的可持续发展息息相关,充分利用好能源是摆在人类面前的重大课题。
Ⅰ.已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH=a kJ·mol-1
②CO(g)+l/2O2(g)=CO2(g) ΔH=b kJ·mol-1
③C(石墨)+O2(g)=CO2(g) ΔH=c kJ·mol-1
则反应4Fe(s)+3O2(g)=2Fe2O3(s)的焓变ΔH= kJ·mol-1。
Ⅱ.依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是 (填序号)。
A.C(s)+CO2(g)=2CO(g) ΔH>0 B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH<0
C.2H2O(l)=2H2(g)+O2(g) ΔH>0 D.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH<0
若以稀硫酸为电解质溶液,则该原电池的正极反应式为 。
Ⅲ.氢气作为一种绿色能源,对于人类的生存与发展具有十分重要的意义。
(1)实验测得,在通常情况下,1 g H2完全燃烧生成液态水,放出142.9 kJ热量。则H2燃烧的热化学方程式为 。
(2)用氢气合成氨的热化学方程式为N2(g)+3H2(g)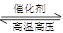 2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1
①一定条件下,下列叙述可以说明该反应已达平衡状态的是 。
A.υ正(N2)=υ逆(NH3)
B.各物质的物质的量相等
C.混合气体的物质的量不再变化
D.混合气体的密度不再变化
②下图表示合成氨反应达到平衡后,每次只改变温度、压强、催化剂中的某一条件,反应速率υ与时间t的关系。其中表示平衡混合物中的NH3的含量最高的一段时间是 。图中t3时改变的条件可能是 。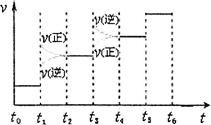
③温度为T℃时,将4a mol H2和2a mol N2放入0.5 L密闭容器中,充分反应后测得N2的转化率为50%,则反应的平衡常数为 。
(共10分)已知有以下物质相互转化关系。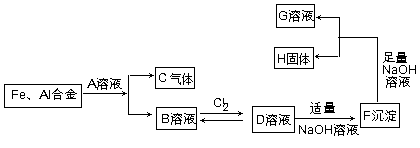
⑴写出化学式 G,H
⑵写出下列转化的离子方程式
B→D;
D→F、.
F→G
A、B、C、D四种化合物,其中A、C、D焰色反应均为黄色,而B的焰色反应为紫色,A、C和盐酸反应均得到D,将固体C加热可得到A,若在A的溶液中通入一种无色无味气体,又可制得C,若B的溶液滴加到硫酸亚铁溶液会先后出现白色沉淀E→灰绿色沉淀→红褐色沉淀F。试推断
(1)A:________、B:________、C、 D(填化学式)
(2) C+盐酸的离子方程式
(3)加热C得到A的化学方程式
除去下列物质中的少量杂质
(1)除去FeSO4溶液中的Fe2(SO4)3
选用试剂或方法: _______________________
离子方程式为 ________
(2)除去Fe(OH)3悬浊液中的Fe(OH)2
选用试剂或方法 __________化学方程式
(3)除去Fe2O3中的Al2O3
选用试剂或方法: 离子方程式为
(4)除去Al2O3中的Al(OH)3
选用试剂或方法: 化学方程式为
某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。该反应中还原产物是_____;若反应过程中转移了0.3 电子,则氧化产物的质量是____。
电子,则氧化产物的质量是____。
A、B、C、D是四种可溶的化合物,分别由阳离子K+、Ba2+、Al3+、Fe3+和阴离子OH―、CO32―、NO3―、SO42―两两组合而成,它们的溶液发生如下反应:
A与B反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失。C与D反应生成有色沉淀,B与C反应生成白色沉淀。写出它们的化学式:
A:_____________;B:_____________;C:_____________;D:_____________。