A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 |
Ag+ Na+ |
| 阴离子 |
NO3- SO42- Cl- |
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、 B、 C三种溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加了27g。常温下各烧杯中溶液的pH与电解时间(t)的关系如图。据此回答下列问题:
(1)M为电源的 极(填“正”或“负”),甲电解质为 (填化学式)。
(2)写出丙烧杯中反应的化学方程式 。
(3)有人设想用图一所示原电池为直流电源完成上述电解。则锌电极相当于直流电源的 (填“M”或“N”)极。
(4)有人设想用图二所示装置做直流电源,不仅可以完成电解也能将气体SO2转化
为重要化工原料。该设想中负极的电极反应式为 。
分有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl等混合而成,为检验它们做了如下实验:
(1)将固体混合物溶于水,搅拌后得无色透明溶液;
(2)往此溶液中滴加硝酸钡溶液,有白色沉淀生成;
(3)过滤,将沉淀物置于稀硝酸中,发现沉淀全部溶解。试判断:
固体混合物中肯定有________,肯定没有________,可能有________,对可能有的物质,可采用滤液中滴加________溶液方法来检验。
(1)常温下,有0.1mol/L的盐酸和0.1mol/L的醋酸溶液,回答下列问题:
①比较两溶液的pH,盐酸(填“<”、“=”或“>”)醋酸,写出醋酸电离的方程式。
②两种酸均能与氢氧化钠反应生成盐,其中醋酸与氢氧化钠反应能生成醋酸钠,实验室现有部分醋酸钠固体,取少量溶于水,溶液呈性(填“酸” 、“中” 或 “碱”),其原因是(用离子方程式表示)。
(2)向盛有1 mL 0.1 mol/L MgCl2溶液的试管中滴加2滴2mol/L NaOH溶液,有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,静置。可以观察到的现象是,产生该现象的原因是(用离子方程式表示)。
如图甲、乙是电化学实验装置。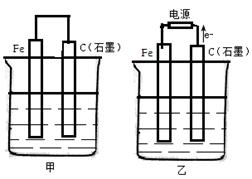
(1)若甲、乙两烧杯中均盛有NaCl溶液,则:
①甲中石墨棒上的电极反应式为;
②乙中总反应的离子方程式为;
③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2 。若反应中Cl2和I2的物质的量之比为5∶1,且 生成两种酸,该反应的化学方程式为。
(2)若甲乙两烧杯中均盛有足量CuSO4溶液,则:
①甲中铁棒上的电极反应式为;
②如果起始时乙中盛有200mLpH=5的CuSO4溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入的物质是(写化学式),其质量为g。
合成气(CO和H2)是重要的化工原料,在工业生产中有着广泛的应用。
(1)工业上用甲烷和水蒸气在高温条件下发生反应制备合成气(CO和H2),4g甲烷完全反应吸收51.5KJ热量,写该反应的热化学方程式
(2)工业上常用合成气来冶炼金属,其中CO还原氧化铁来冶炼生铁方程式如下:
3CO(g)+Fe2O3(s) 3CO2(g)+ 2Fe(s)△H<0
3CO2(g)+ 2Fe(s)△H<0
①如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,。
| A.容器中Fe2O3的质量不随时间而变化 | B.反应物不再转化为生成物 |
| C.n (CO) :n (CO2) = 1:1 | D.容器中气体的压强不随时间而变化 |
②在一个容积为4L的密闭容器中,1000℃时加入4mol CO(g)和足量Fe2O3(s),反应2分钟后达到平衡,测得此时容器内气体的密度为40g/L,求该时间范围内反应的平均反应速率υ(CO2)= ___、CO的平衡转化率= _____、该反应的化学平衡常数K=。
(1)利用盖斯定律可以从已经精确测定的反应热效应来计算难于测量或不能测量的反应的热效应。已知:N2(g)+ 2O2(g)="=" 2NO2(g) ΔH=" +67.7" kJ·mol-1,
N2H4(g)+ O2(g)="=" N2(g)+ 2H2O(g) ΔH=" -534" kJ·mol-1。
请写出气态肼与NO2气体完全反应生成氮气和水蒸气的热化学方程式:。
(2)已知:N≡N的键能是946kJ·mol-1,H—H的键能为436kJ·mol-1,N—H的键
能为393kJ·mol-1,计算合成氨反应生成1molNH3的△H=kJ·mol-1。
(3)现有25℃、pH=13的Ba(OH)2溶液,
①该Ba(OH)2溶液的物质的量浓度为________
②加水稀释100倍,所得溶液中由水电离出c(OH-)=____________
③与某浓度盐酸溶液按体积比(碱与酸之比)1 : 9混合后,所得溶液pH=11,该盐酸溶液的pH=________。
(4)回答醋酸与氢氧化钠反应的有关问题
①将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈(填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+) c(CH3COO-)(填“ >” 或“=” 或“<” )。
②pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈,溶液中c(Na+)
c(CH3COO-) .
③物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈,醋酸体积氢氧化钠溶液体积。