分以电石渣(主要成分是Ca(OH)2,含SiO2以及其它少量杂质)为原料生产氯酸钾联合生产碳酸钙的流程如下: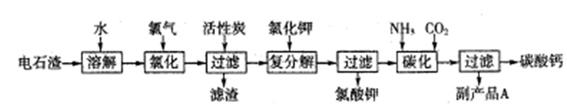
回答下列问题:
(1)电石渣溶于水形成电石渣浆时发生的主要反应的化学方程式为:
(2)氯化过程的温度控制在75~80℃,该过程主要反应的离子方程式为:
(3)该流程中加入活性炭的作用是
(4)碳化过程中,先向溶液中通入氨气,再通入CO2。
①实验室通常采用加热氯化铵和氢氧化钙混合物的方法制取氨气。某学习小组选取下图所给部分装置制取并收集纯净的氨气。
如果按气流方向连接各仪器接口,你认为正确的顺序为a→ 、 → 、 →i。其中与i相连漏斗的作用是 。
②实验室中还可用固体氢氧化钠和浓氨水制取少量氨气,下列最适合完成该实验的简易装置是 (填编号)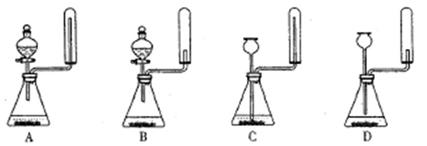
(5)副产品A的化学式为 。
【2015上海化学】(本题共12分)氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。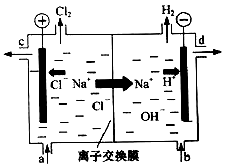
完成下列填空:
(1)写出电解饱和食盐水的离子方程式 。
(2)离子交换膜的作用为: 、 。
(3)精制饱和食盐水从图中 位置补充,氢氧化钠溶液从图中 位置流出。(选填“a”、“b”、“c”或“d”)
(4)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。
写出该反应的化学方程式 。
(5)室温下,0.1 mol/L NaClO溶液的pH 0.1 mol/L Na2SO3溶液的pH。(选填“大于”、“小于”或“等于”)。浓度均为0.1 mol/L 的Na2SO3和Na2CO3的混合溶液中,SO32–、CO32–、HSO3–、HCO3–浓度从大到小的顺序为 。
已知: H2SO3 Ki1=1.54×10-2 Ki2=1.02×10-7
HClO Ki1=2.95×10-8
H2CO3 Ki1=4.3×10-7 Ki2=5.6×10-11
【2015上海化学】(本题共12分)甲醛是深受关注的有机化合物。甲醛含量的测定有多种方法,例如:在调至中性的亚硫酸钠溶液中加入甲醛水溶液,经充分反应后,产生的氢氧化钠的物质的量与甲醛的物质的量相等,然后用已知浓度的硫酸滴定氢氧化钠。
完成下列填空:
(1)将4.00 mL甲醛水溶液加入到经调至中性的亚硫酸钠溶液中,充分反应后,用浓度为1.100 mol/L的硫酸滴定,至终点时耗用硫酸20.00 mL。
甲醛水溶液的浓度为 mol/L。
(2)上述滴定中,若滴定管规格为50mL,甲醛水溶液取样不能超过 mL。
(3)工业甲醛含量测定的另一种方法:在甲醛水溶液中加入过氧化氢,将甲醛氧化为甲酸,然后用已知浓度的氢氧化钠溶液滴定。
HCHO + H2O2 → HCOOH + H2O
NaOH + HCOOH → HCOONa + H2O
已知H2O2能氧化甲酸生成二氧化碳和水。
如果H2O2用量不足,会导致甲醛含量的测定结果 (选填“偏高”、“偏低”或“不受影响”),因为 ;如果H2O2过量,会导致甲醛含量的测定结果 (选填“偏高”、“偏低”或“不受影响”),因为 。
(4)甲醛和新制氢氧化铜的反应显示了甲醛的还原性,发生反应的化学方程式通常表示如下:
HCHO + 2Cu(OH)2 HCOOH + Cu2O↓ + 2H2O
HCOOH + Cu2O↓ + 2H2O
若向足量新制氢氧化铜中加入少量甲醛,充分反应,甲醛的氧化产物不是甲酸或甲酸盐,设计一个简单实验验证这一判断。
①主要仪器:试管 酒精灯
②可供选用的试剂:硫酸铜溶液、甲醛、甲酸、氢氧化钠溶液
【2015山东理综化学】(15分)利用LiOH和钴氧化物可制备锂离子电池正极材料。LiOH可由电解法制备,钴氧化物可通过处理钴渣获得。
(1)利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。B极区电解液为________溶液(填化学式),阳极电极反应式为_________,电解过程中Li+向_____电极迁移(填“A”或“B”)。
(2)利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程如下:
Co(OH)3溶解还原反应的离子方程式为___________,铁渣中铁元素的化合价为___________,在空气中煅烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),则钴氧化物的化学式为__________。
(15分)某铜矿石的成分中含有Cu2O,还含有少量的Al2O3、Fe203和Si02。某工厂利用此矿石炼制精铜的工艺流程示意图如下:
已知:CuO2+2H+=Cu+Cu2++H2O
(1)滤液A中铁元素的存在形式为 (填离子符号),生成该离子的离子方程式为 ,检验滤液A中存在该离子的试剂为 (填试剂名称)。
(2)金属E与固体F发生的某一反应可用于焊接钢轨,该反应的化学方程式为 。
(3)常温下.等pH的NaAlO2和NaOH两份溶液中,由水电离出的c(OH一)前者为后者的108倍,则两种溶液的pH= 。
(4)将Na2CO3溶液滴入到一定量的CuCl2溶液中,除得到蓝色沉淀,还有无色无味气体放出,写出相应的离子方程式: 。
(5)①粗铜的电解精炼如图所示。在粗铜的电解精炼过程中,c为粗铜板,则a端应连接电源的 (填“正”或“负”)极,若粗铜中含有Au、Ag、Fe杂质,则电解过程中c电极上发生反应的方程式有 、 。
②可用酸性高锰酸钾溶液滴定法测定反应后电解液中铁元素的含量。滴定时不能用碱式滴定管盛放酸性高锰酸钾溶液的原因是 、滴定中发生反应的离子方程式为 ,滴定时.锥形瓶中的溶液接触空气,则测得铁元素的含量会 (填“偏高”或“偏低”)。
(14分)某研究小组为了探究SO2的实验室制法和有关化学性质,设计了如下的实验。
实验I:
(1)实验基本操作分析:
①多孔隔板与活塞相配合,能起到的作用是_________________________________.
②该实验制H2时需用浓硫酸配制480mL 3 mol/L的稀硫酸,配制中所需的玻璃仪器有250 mL烧杯、l 00mL量筒、玻璃棒、胶头滴管等,还需_______________________.
③该实验过程中H2所起的作用是_____________________________.
(2)实验时先打开活塞,让装置A内试剂反应一段时间后,关闭活塞,再往装置B中滴入适量浓硫酸反应片刻后,甲、乙两学生分别取装置D中少量溶液,甲学生往其中加入酸性KMnO4溶液,观察到酸性KMn O4溶液紫红色褪去;乙学生往其中加入盐酸酸化的BaCl2溶液,观察到有白色沉淀生成。根据各自实验现象甲、乙学生得出SO2被Fe3+氧化。
①试判断甲、乙学生的结论是否严谨________________(填写选项)。
A.甲学生严谨 B.乙学生严谨 C.甲、乙学生都不严谨
②写出SO2被Fe3+氧化的离子反应方程式_____________________________________.
实验II:
(3)该研究小组为测定SO2催化氧化为SO3的转化率,又设计了如下实验:已知SO3熔点为16.8℃,且忽略空气中CO2的影响).
①当停止通入SO2,熄灭酒精灯后,需要继续通入氧气,其目的是________________.
②实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是_______________(用含字母的代数式表示,不用化简)。