)氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按下图所示步骤进行操作。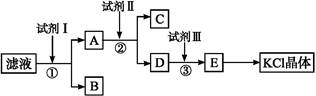
回答下列问题:
(1)起始滤液的pH 7(填“大于”“小于”或“等于”),其原因是 ;
(2)试剂Ⅰ的化学式为 ,①中发生反应的离子方程式为 ;
(3)试剂Ⅱ的化学式为 ,②中加入试剂Ⅱ的目的是 ;
(4)试剂Ⅲ的名称是 ,③中发生反应的离子方程式为 ;
(5)某同学称取提纯的产品0.775 9 g,溶解后定容在100 mL容量瓶中,每次取25.00 mL溶液,用0.100 0 mol·L-1的硝酸银标准溶液滴定,三次滴定消耗标准溶液的平均体积为25.62 mL,该产品的纯度为 。(列式并计算结果)
(18分)硫酸铜溶液常用于农业上制波尔多液。下图是用废铜料(铁、铜混合物)来生产硫酸铜的过程,请根据图示回答下列问题。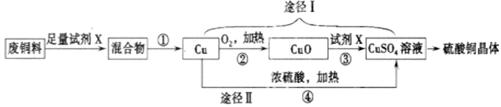
(1)试剂X的化学式为_______________,操作①的名称为_______________。
(2)甲同学认为途径Ⅰ比途径Ⅱ更为合理,其理由是_________(填编号)
a.对环境污染少 b.反应速率快
c.铜的利用率高 d.硫酸的利用率高
(3)实验室用浓硫酸与铜反应,采用下列装置制备并收集干燥的SO2气体。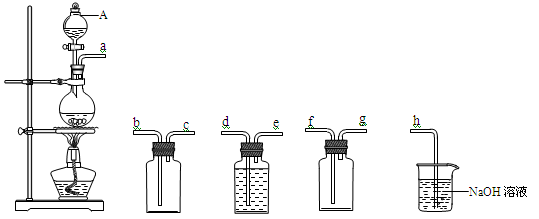
①A装置的名称_______________。
②连接上述仪器的正确顺序是(填各接口处的字母):a接______,______接______,______接______,______接h。
③反应终止后,发现烧瓶中有黑色物质出现,其中可能含有CuO、CuS等杂质。已知硫化铜不与H+反应,与足量稀硝酸反应生成Cu2+、+6价的S和NO气体,该反应的离子方程式为____________。利用所给试剂设计实验,检测黑色物质中是否存在CuS。其方案为:将烧瓶中混合物加入到蒸馏水中,充分反应后过滤,向滤渣中 _____________(补充实验操作、现象和结论)。
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、氯化钡溶液、硝酸银溶液
碳酸钠在轻工、建材、纺织、国防、医药等工业中有重要的应用。
(1)工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺线路如下:
碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示
请回答下列问题:
①试剂A是________,“母液”中除了含有Na+、CO32-、OH-离子外,还含有________等离子,过滤要“趁热”的目的是________。
②检验试剂级Na2CO3中Cl-和SO42-是否除尽,选用的试剂及加入的先后次序是________(填序号)。
a.HCl、BaCl2、AgNO3
b.AgNO3、HNO3、Ba(NO3)2
c.HNO3、Ba(NO3)2、AgNO3
d.AgNO3、HCl、BaCl2
(2)“侯氏制碱法”的原理:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
下图是某兴趣小组在实验室中模拟“侯氏制碱法”制取所用到的主要装置。
请回答下列问题:
①各仪器口的链接顺序为a接________,________接________,________接b,实验时先向饱和NaCl溶液中通入较多的NH3,再通人足量的CO2,其原因是________(填写序号字母)。
a.使CO2更易被吸收
b.NH3比CO2更易制取
c.CO2的密度比NH3大
②将生成的NaHCO3晶体从混合物中分离出来需要的玻璃仪器是________。
③该兴趣小组用下图比较C、N、Si三种元素的非金属性强弱,B中的试剂是________,能说明碳的非金属性比硅强的实验现象是________(H2SiO3是一种不溶于水的白色胶状物)。
某研究性学习小组选用以下装置进行实验设计和探究(图中a、b、c均为止水夹)
(1)在进行气体制备时,应先检验装置的气密性。将A装置末端导管密封后,在A装置的分液斗内装一定量的蒸馏水,然后,则证明A装置的气密性良好。
(2)用锌粒和稀硫酸制备H2时应选用装置____作为发生装置(填所选装置的序号字母),实验时可先在稀硫酸溶液中加入少量硫酸铜晶体会使反应速率加快,原因是。
(3)某同学利用上述装置设计实验证明Cl2氧化性强于Br2
①选用的装置连接顺序为:()→()→()(填所选装置的序号字母);
②从以下试剂中选用该实验所需的试剂为(填试剂的序号字母);
a.浓硫酸
b.浓盐酸
c.二氧化锰
d.氯化钠
e.溴化钠溶液
③实验过程中能说明Cl2氧化性强于Br2的实验现象是;
(4)另一同学将B、D、E装置连接后,在B装置中加入铜片和浓硝酸制取NO2,然后进行NO2气体与水反应的实验,并观察相关现象:
①B装置发生反应的离子方程式为____;
②反应一段时间后D装置中的具支试管乙中收集满NO2气体,若进行NO2气体与水反应的实验,应(填“对a、b、c三个止水夹进行的操作”),然后再适当加热乙;实验现象为。
③E装置中的NaOH溶液可吸收尾气NO2,反应生成NaNO3、NaNO2和H2O,反应中生成的NaNO3和NaNO2的物质的量之比为。
软锰矿的主要成分为MnO2,还含有Fe2O3、MgO、Al2O3、CaO、SiO2等杂质,工业上用软锰矿制取MnSO4·H2O的流程如下:
已知①部分金属阳离子完全沉淀时的pH如下表
②温度高于27℃时,MnSO4晶体的溶解度随温度的升高而逐渐降低。
(1)“浸出”过程中MnO2转化为Mn2+的离子方程式为。
(2)第1步除杂中加入H2O2的目的是。
(3)第1步除杂中形成滤渣l的主要成分为(填化学式),调pH至5-6所加的试剂,可选择(填以下试剂的序号字母);
a.CaO b.MgO c.Al2O3 d.氨水
(4)第2步除杂主要是将Ca2+、Mg2+转化为相应氟化物沉淀除去,写出MnF2除去Mg2+的离子反应方程式,该反应的平衡常数数值为。
(已知:MnF2的Ksp(MnF2)= 5.3×10-3;CaF2的Ksp(CaF2)= 1.5×10-10;MgF2的Ksp(MgF2)=7.4×10-11)
(5)采用“趁热过滤”操作的原因是。
(6)取少量MnSO4·H2O溶于水,配成溶液,测其pH发现该溶液显酸性,原因是(用离子方程式表示),该溶液中所有离子的浓度由大到小的顺序为。
高纯度镍是许多有机反应的催化剂。某化学课题组拟以电镀废液(含有NiSO4、CuSO4和FeSO4)为原料,设计提取高纯镍的简单工艺如下(阴离子省略):
| 难溶电解质 |
NiS |
CuS |
Cu(OH)2 |
Ni(OH)2 |
Fe(OH)3 |
| Ksp或沉淀完全的pH |
1.1×10-21 |
1.3×10-36 |
pH=9 |
pH=9.5 |
pH=3.7 |
注:Ni(OH)2开始沉淀时的pH=7。
(1)加入新制氯水所发生反应的离子方程式为。
(2)加入NiCO3的目的是。
(3)在实验室中灼烧所使用的仪器有。
(4)由氧化镍制备高纯度镍,有两种方案:
方案1:氧化镍溶于稀硫酸,加入足量锌粉,过滤、洗涤、干燥。
方案2:锌与稀硫酸反应产生氢气,氢气还原氧化镍。
制备等质量的镍粉,从消耗原料量、产品纯度、实验安全等角度评价两种方案的优点。
方案1:。
方案2:。
(5)方案2所用的氢气可以选用下列装置中的来制取(填写字母,下同),收集氢气可选用装置。
(6)若将D装置和E装置相连制取并收集干燥纯净的X气体,则X气体可以是下列气体中的。装置D中导管a的作用是。
a.CO2 b.Cl2 c.NO d.SO2