可用呋喃为主要原料合成聚酰胺纤维(尼龙-66,含有-CO-NH-结构),合成路线如下:

回答下列问题:
(1)写出反应类型:反应③________________;反应⑥________________。
(2)写出A、B的结构筒式:
A________________________________;B________________________________。
(3)写出有关的化学方程式:
反应②________________________________________________________________
反应⑥________________________________________________________________
(4)呋喃与苯相似,也具有芳香性,则可推知呋喃能发生的化学反应是__________ (选填编号)。
a.使溴水褪色 b.使酸性高锰酸钾溶液褪色 c.与溴发生取代反应 d.发生l,4加成反应
(5)写出乙酰胺制取乙腈(CH3C≡N)的化学方程式:_______________________________。
(6)H是A的同分异构体,被酸性高锰酸钾溶液氧化生成丙二酸和CO2,则H的结构简式为___________。
已知烃B分子内C、H原子个数比为1∶2,相对分子质量为28,核磁共振氢谱显示分子中只有一种化学环境的氢原子,且有如下的转化关系: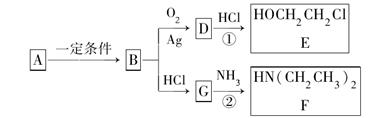
(1)B的结构简式是__________。
(2)A可能属于下列哪类物质__________。
a.醇b.卤代烃c.酚d.羧酸
(3)反应①是D与HCl按物质的量之比1∶1的加成反应,则D的分子式是__________。反应②可表示为:G+NH3―→F+HCl(未配平),该反应配平后的化学方程式为______________________。
化合物E和F是合成药品普鲁卡因的重要中间体,普鲁卡因的合成路线如下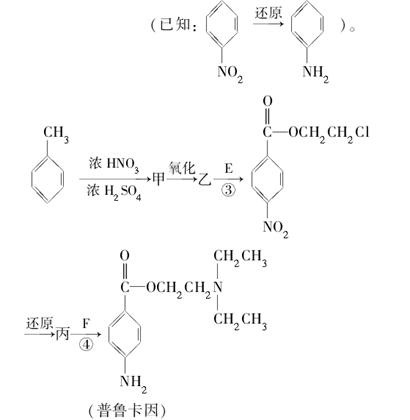
(4)甲的结构简式是__________。由甲苯生成甲的反应类型是__________。
(5)乙中有两种含氧官能团,反应③的化学方程式是____________________。
(6)普鲁卡因有两种水解产物丁和戊。
①戊与甲互为同分异构体,戊的结构简式是______________________。
②戊经聚合反应制成的高分子纤维广泛应用于通讯、宇航等领域。该聚合反应的化学方程式为______________________。
有机物A只由C、H、O三种元素组成,常用作有机合成的中间体,16.8 g该有机物经燃烧测得生成44.0 g CO2和14.4 g水,质谱图表明其相对分子质量为84;红外光谱分析表明A中含有O—H键和位于分子端的CC键,核磁共振氢谱显示有3个峰,峰面积比为6:1:1。
(1)写出A的分子式:________;
(2)写出A的结构简式:________;
(3)下列物质一定能与A发生反应的是________(填序号);
a.H2 b.Na c.KMnO4 d.Br2
(4)有机物B是A的同分异构体,1 mol B可以与1 mol Br2加成,该有机物所有碳原子在同一平面上,没有顺反异构现象,则B的结构简式为________。
在一定条件下,烯烃可发生臭氧氧化还原水解反应,生成羰基化合物,该反应可表示为: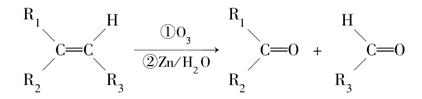
已知:
①化合物A,其分子式为C9H10O,它既能使溴的四氯化碳溶液褪色,又能与FeCl3溶液发生显色反应,且能与金属钠或NaOH溶液反应生成B;
②B发生臭氧氧化还原水解反应生成C,C能发生银镜反应;
③C催化加氢生成D,D在浓硫酸存在下加热生成E;
④E既能使溴的四氯化碳溶液褪色,又能与FeCl3溶液发生显色反应,且能与NaOH溶液反应生成F;
⑤F发生臭氧氧化还原水解反应生成G,G能发生银镜反应,遇酸转化为H(C7H6O2)。
请根据上述信息,写出下列化合物的结构简式(如有多组化合物符合题意,只要求写出其中的一组)。
A:________;C:________;E:________。
化合物A是合成天然橡胶的单体,分子式为C5H8。A的一系列反应如下(部分反应条件略去):
回答下列问题:
(1)A的结构简式为________,化学名称是________;
(2)B的分子式为________;
(3)②的反应方程式为________;
(4)①和③的反应类型分别是________,________;
(5)C为单溴代物,分子中有两个亚甲基,④的化学方程式为________;
(6)A的同分异构体中不含聚集双烯(CCC)结构单元的链状烃还有________种,写出其中互为立体异构体的化合物的结构简式:________。
蛋白质是一类复杂的含氮化合物,每种蛋白质都有其恒定的含氮量[约在14%~18%(本题涉及的含量均为质量分数)],故食品中蛋白质的含量测定常用凯氏定氮法。其测定原理是:
Ⅰ.蛋白质中的氮(用氨基表示)在强热和CuSO4、浓H2SO4作用下,生成一种无机含氮化合物,反应式为:2—NH2+H2SO4+2H+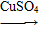 ________。
________。
Ⅱ.该无机化合物在凯氏定氮器中与碱作用,通过蒸馏释放出NH3,收集于H3BO3溶液中,生成(NH4)2B4O7。
Ⅲ.用已知浓度的盐酸标准溶液滴定,根据盐酸的消耗量计算出氮的含量,然后乘以相应的换算系数,即得蛋白质的含量。
(1)上述原理第Ⅰ步生成的无机含氮化合物化学式为________。
(2)乳制品的换算系数为6.38,即若检测出氮的含量为1%,蛋白质的含量则为6.38%。不法分子通过在低蛋白含量的奶粉中加入三聚氰胺(Melamine)来“提高”奶粉中的蛋白质含量,导致许多婴幼儿患肾结石。
①三聚氰胺的结构如图所示,其化学式为________,含氮量(氮元素的质量分数)为________;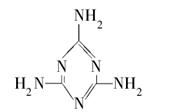
②下列关于三聚氰胺的说法中,正确的有________
A.三聚氰胺是一种白色结晶粉末,没有什么气味和味道,所以掺入奶粉后不易被发现
B.三聚氰胺分子中所有原子可能在同一个平面上
C.三聚氰胺呈弱碱性,可以和酸反应生成相应的盐
③假定奶粉中蛋白质的含量为16%即为合格,不法分子在一罐总质量为500 g、蛋白质含量为0的假奶粉中掺入多少克的三聚氰胺就可使奶粉“达标”?