某同学用下图所示装置制取氯水并进行相关实验。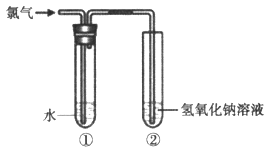
(1)装置②中反应的化学方程式是__________。
(2)实验进行一段时间后,装置①中溶液呈黄绿色,说明该溶液中含有的一种物质是(填化学式)__________。
(3)取少量装置①中的溶液滴在蓝色石蕊试纸上,试纸先变红后褪色,说明氯水具有的性质是__________。
(4)下列物质能替代NaOH溶液的是__________(填字母)。
a.浓硫酸 b.FeCl2溶液 c.饱和食盐水
(5)欲验证Cl2的氧化性强于I2,取少量装置①中的溶液加入盛有__________(填“KI”或“KIO3”)溶液的试管中,用力振荡后加入少量四氯化碳,振荡、静置,观察到的现象是__________。
现有0.1mol·L-1的Na2SO4和0.1mol·L-1的H2SO4混合溶液100mL,向其中逐滴加入0.2mol·L-1的Ba(OH)2溶液,并不断搅拌,使反应充分进行。(忽略溶液体积变化)
⑴当加入50mLBa(OH)2溶液时,发生反应的总离子方程式为,所得溶液中的溶质物质的量浓度为mol·L—1(保留小数点后3位数字);
⑵当溶液中沉淀量达到最大时,所加Ba(OH)2溶液的体积为mL,所得溶液溶质物质的量浓度为 mol·L-1。
有一固体混合物,可能由Na2CO3、Na2SO4、FeSO4、CaCl2、NaCl等混合而成,为检验它们,做了以下实验:
① 将固体混合物溶于水中,搅拌后得无色透明溶液;
② 往此溶液中滴加硝酸钡溶液,有白色沉淀产生;
③ 过滤,将沉淀物置于足量稀硝酸中,发现沉淀部分溶解。
根据上述实验事实,回答下列问题:
(1)原固体混合物中一定含有的物质是,一定不含有的物质是,(均填化学式)。对可能含有的物质,可采用向滤液中滴加溶液的方法来检验。
(2)写出步骤③中的离子方程式。
根据反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O回答下列问题:
(1)氧化剂是,氧化产物是。
(2)氧化剂与氧化产物的物质的量比是。
(3)当有2 mol HNO3被还原时,被氧化的物质的质量为,反应中转移的电子数为;
(4)有下列6种物质:K2SO4、K2SO3、I2、H2SO4、KIO3、H2O组成一个氧化还原反应,已知在反应中K2SO3失去电子。请回答下列问题:
将这6种物质分别填入下面对应的横线上,组成一个化学方程式(不需配平):
________+________+________ → ________+________+________
化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
(1)从物质的分类角度看,不恰当的一种物质是(填化学式)。
(2)“三酸”与“两碱”之间均可反应,酸过量时若用化学方程式表示有六个,若用离子方程式表示却只有两个,请写出这两个离子方程式、。
(14分)某化学反应2A(g) B(g)+D(g)在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况,根据下述数据,完成下列填空:
B(g)+D(g)在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况,根据下述数据,完成下列填空:
| 实验 序号 |
温度/℃ |
时间/min |
||||||
| 0 |
10 |
20 |
30 |
40 |
50 |
60 |
||
| 1 |
800℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
| 2 |
800℃ |
c2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
| 3 |
800℃ |
c 3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
| 4 |
820℃ |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
(1)在实验l过程中,10 min~20 min时间内用B表示该反应的平均化学反应速率为mol/(L·min)。
(2)在实验2过程中,A的初始浓度c2=mol/L,反应经20min就达到平衡,可推测实验2中还隐含的条件是。
(3)设实验3的化学反应速率为v3,实验1的化学反应速率为v1,则v3v1,且c31.0 mol/L (填“<”、“>”或“=”)。
(4)比较实验4和实验l,可推测该反应是反应(填“吸热”或“放热”)。理由是
。