在一百多种化学元素中,非金属占了23种。80%的非金属元素在社会中占重要位置。如C、N、O、Si、Cl等。
(1)氯元素原子最外电子层上有 种能量不同的电子,该元素的简单阴离子核外电子排布式是 。
(2)由氮元素与硅元素组成的物质,可用于制造发动机的耐热部件,因为它属于 晶体,请写出该化合物的化学式 。
(3)下列事实能说明氯与氧两元素非金属性相对强弱的有 。(选填编号)
a.Cl原子最外层电子数比氧多
b.酸性:HCl>H2O
c.ClO2中氯元素为+4价,氧元素为−2价
d.沸点:H2O>HCl
与Cl2相比较,ClO2处理水时被还原成Cl-,不生成有机氯代物等有害物质。工业上可用亚氯酸钠和稀盐酸为原料制备ClO2,反应如下:NaClO2 +HCl ClO2↑+___________________(没有配平)
ClO2↑+___________________(没有配平)
(4)上述方程式中,缺项物质是___________,配平方程式,并在下面补全反应物系数。____NaClO2 +____HCl
(5)该反应中氧化剂和还原剂的物质的量之比是 。生成0.2 mol ClO2转移电子的物质的量为_______ mol。
(6)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某污水中含CN-a mg/L,现用ClO2将CN-氧化,只生成两种无毒气体。处理100m3这种污水,至少需要ClO2 _______ mol 。
有机物F(C9H10O2)是一种有茉莉花香味的酯。用下图所示的方法可以合成F。其中A是相对分子质量为28的烃,其产量常作为衡量石油化工发展水平的标志。E是只含碳、氢、氧的芳香族化合物,且苯环上只有一个侧链。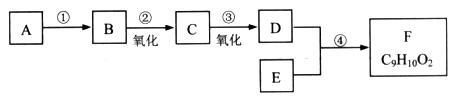
回答下列问题:
(1)A的分子式是____________;
(2)B的结构简式是________________________;
(3)为检验C中的官能团,可选用的试剂是____________;
(4)反应④的化学方程式是__________________。
下图是某烃A分子的球棍模型。回答下列问题: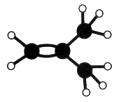
(1)A的名称是________________________;
(2)A能够发生的反应类型有____________(填序号);
A. 氧化反应 B. 加成反应 C. 消去反应
(3)A与溴的四氯化碳溶液反应的化学方程式是________________________________。
有机物具有广泛的用途。现有下列有机物:①乙烯 ②1,3-丁二烯 ③甲醛 ④油脂。请将相应的序号填入空格内。
(1)能用于制备肥皂的是____________;(2)能用于制备聚乙烯塑料的是____________;
(3)能用于制备顺丁橡胶的是____________;(4)能用于制备酚醛树脂的是____________。
乙炔与乙烯类似,在催化剂(10%硫酸和5%硫酸汞的水溶液)的作用下,也可以与等物质的量的水发生加成反应。
(1)已知当羟基和双键碳原子直接相连,呈烯醇结构不稳定,会转化为羰基化合物: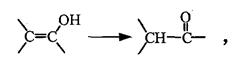
则乙炔和水加成的化学方程式是。
用如下装置完成乙炔和水的加成反应,加成产物收集在D装置中。(省略部分加热和夹持仪器)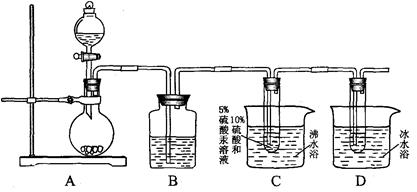
①实验室制备乙炔的化学方程式是。
②A装置制出的乙炔有难闻的气味,为除去这些杂质,装置B中盛放的试剂是。
③C装置采用沸水浴的作用是(填字母)。
a.便于控温,使受热均匀 b.加热反应物,提高化学反应速率 c.蒸出生成物
(3)为检验加成产物中的官能团,选择的药品是(填字母)。
a.金属钠 b.10%氢氧化钠溶液 c.2%硫酸铜溶液
d.2%硝酸银溶液 e.饱和碳酸钠溶液
检验官能团的实验中,发生反应的化学方程式是 。
有机物 与Br2发生1∶1加成反应,其可能的加成产物的结构简式有:
与Br2发生1∶1加成反应,其可能的加成产物的结构简式有:
。