在常温下,下列四种溶液中:
①0.1mol/L NH4Cl ②0.1mol/LCH3COONH4 ③0.1mol/L NH4HSO4
④0.2mol/L NH3·H2O和0.2mol/L NH4Cl溶液等体积混合,溶液呈碱性
(1)溶液①呈 性(填“酸”、“碱”或“中”),其原因是 (用离子方程式表示),其离子浓度由大到小的排列为_______________________
(2)比较上述四种溶液中NH4+的浓度大小 (填序号)
(3)常温下,测得溶液②的PH=7,则说明CH3COO--的水解程度 (填“大于”、“小于”或“等于”,下同)NH4+的水解程度,CH3COO--与NH4+浓度的大小关系是:c(CH3COO--) c(NH4+)。
(4)在溶液④中, 离子的浓度为0.1mol/L;NH3·H2O和NH4+离子的物质的量浓度之和
为 mol/L。
市场上出售的“热敷袋”的主要成分是铁屑、炭粉、木屑、少量氯化钠和水等。“热敷袋”启用之前用塑料袋使其与空气隔绝,启用时,打开塑料袋轻轻揉搓就会放出热量,使用完后,会发现有大量铁锈存在。
(1)热敷袋是利用________放出热量。
(2)炭粉的主要作用是__________________________________。
(3)加入氯化钠的主要作用是____________________________。
(4)木屑的作用是______________________________________。
(5)有关的电极反应式和化学方程式是____________________________________________。
(1)普通锌锰干电池的结构如图所示。回答下列问题。
①电池中电解质溶液为________。
②正极反应式为________。
③放电时,NH4+向________(填“正极”或“负极”)移动。
(2)废电池中的锌皮常用于实验室制氢气,废锌皮和纯锌粒分别与同浓度的稀硫酸反应,产生氢气速率较大的是________,原因是________________________。
若用过量的纯锌粒与一定量的稀硫酸反应,为了加快反应速率又不影响产生氢气的量,下列措施可行的是________(填序号)。
| A.微热 |
| B.加入适量氧化铜 |
| C.加入少量硫酸铜溶液 |
| D.加水 |
E.加入少量氢氧化钡溶液
化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)目前常用的镍镉(Ni—Cd)电池,其电池总反应可以表示为:
Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2
2Ni(OH)2+Cd(OH)2
已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法正确的是________(填字母序号)。
①以上反应是可逆反应 ②以上反应不是可逆反应 ③充电时化学能转变为电能 ④放电时化学能转变为电能
| A.①③ | B.②④ |
| C.①④ | D.②③ |
(2)废弃的镍镉电池已成为重要的环境污染物,有资料表明,一节废镍镉电池可以使1 m2面积的耕地失去使用价值。在酸性土壤中这种污染尤为严重,这是因为______________________。
(3)另一种常用的电池锂电池(锂是一种碱金属元素,其相对原子质量为7),由于它的比容量(单位质量电极材料所能转换的电能)特别大而广泛应用于心脏起搏器,一般使用时间可长达十年,它的负极由金属锂制成,电池总反应可表示为Li+MnO2=LiMnO2。
试回答:锂电池比容量特别大的原因是___________________________。
锂电池中的电解质溶液需用非水溶液配制,为什么这种电池不能使用电解质的水溶液?请用化学方程式表示其原因:___________________________________________________。
为了探究原电池的工作原理,某化学学习小组设计了一组实验,其装置如下图:
回答下列问题:
(1)根据原电池原理填写下表:
| 装置序号 |
正极 |
负极反应式 |
阳离子移动方向 |
| 甲 |
|||
| 乙 |
|||
| 丙 |
|||
| 丁 |
|||
| 戊 |
(2)电极类型除与电极材料的性质有关外,还与________有关。
(3)根据上述电池分析,负极材料是否一定参加电极反应?_____
(填“是”“否”或“不一定”),请举例说明:__________________________________________。
(4)指出下列电池的放电过程中,电解质溶液酸碱性的变化:甲_______,丙_______,戊_______。(填酸性或碱性增强或减弱)
利用生活中或实验室中常用的物品,根据氧化还原反应知识和电学知识,自己动手设计一个原电池。请填写下列空白:
(1)实验原理:Fe+2H+=Fe2++H2↑。
(2)实验用品:电极________、________、稀硫酸、________(填写所缺的实验用品)、耳机(或者电流计)。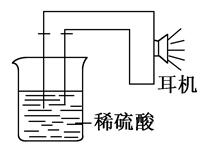
(3)实验装置:
(4)原电池设计及注意的问题。
①按如图所示连接好实验仪器,注意观察(耳朵听)耳机是否有声音发出,如果没有,可将原电池的两个电极中的一极接触耳机插头上的一极(注意:接触的同时耳机的另一个极是连接在原电池的另一个电极上的),这时可以听见耳机发出“嚓嚓嚓”声音。其原因是:在原电池中,由化学能转化为________。
②如果将装置中的耳机改为电流计,则铁钉应该接电流计的______
极,电极反应是________________;另一极应该接电流计的________极,电极发生了________反应(“氧化”或“还原”)。