Q、R、X、Y、Z五种元素的原子序数依次递增。已知:①Z的原子序数为29,其余的均为短周期主族元素;②Y原子价电子(外围电子)排布msnmpn ③R原子核外L层电子数为奇数;④Q、X原子p轨道的电子数分别为2和4。请回答下列问题:
(1)Z2+的核外电子排布式是
(2)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是 。
| A.稳定性:甲>乙,沸点:甲>乙 | B.稳定性:甲>乙,沸点:甲<乙 |
| C.稳定性:甲<乙,沸点:甲<乙 | D.稳定性:甲<乙,沸点:甲>乙 |
(3)Q、R、Y三种元素的第一电离能数值由小到大的顺序为 (用元素符号作答)。
(4)五种元素中,电负性最大与最小的两种非金属元素形成的化合物的化学式为 。
(5)Q的一种氢化物相对分子质量为28,其中分子中的σ键与π键的键数之比为 ,该氢化物与氧气形成的燃料电池在碱性电解质中负极反应为 。
若有等体积的a:PH=1的盐酸,b:PH=1的硫酸,c:物质的量浓度为0.1 mol·L-1的醋酸(均用物质序号回答下列问题):
①欲均加水稀释到相同PH值,所加水的体积关系是:。
②分别加入足量的锌粉,产生氢气体积(相同温度和压强)大小关系是
③某学生用蒸馏水润湿的PH试纸测定PH值,误差最小的是
(用化学用语及必要的文字回答)
(1) 配制碳酸钾溶液要加少量的_____,原因是____。
(2)FeCl3溶液蒸干并灼烧得到的固体是___ __,原因是______。
(8分)有四种钠的化合物W、X、Y、Z,根据以下反应式判断W、X、Y、Z的化学式
(1) W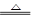 X + CO2↑ + H2O
X + CO2↑ + H2O
(2)Z + CO2→ X + O2↑
(3)Z + H2O→ Y + O2↑
(4)X +Ca(OH)2→ Y + CaCO3↓
则:W XYZ
有一固体粉末,其中可能含有Na2CO3、NaCl、Na2SO4、CuCl2、Ba(NO3)2、K2CO3、K2SO4中的一种或几种,现按下列步骤进行实验。
(1)将该粉末溶于水得无色溶液和白色沉淀。
(2)在滤出的沉淀中加入过量稀硝酸,有部分沉淀溶解,同时产生无色气体。
(3)取滤液做焰色反应,火焰呈黄色,透过蓝色的钴玻璃观察,未见紫色火焰。由上述现象推断:该混合物中一定有、、
;一定不含有、、;
可能含有。
(6分)已知0.1 mol/L的NaHSO4溶液中H+的物质的量浓度为0.1mo1/L,请回答下列问题:
(1)写出NaHSO4在水溶液中电离的方程式。
(2)若将NaHSO4与Ba (OH)2在溶液中按物质的量之比为2:1混合,化学反应的离子方程式是。