(1)请在下图所示元素周期表中用实线画出主族元素的边界。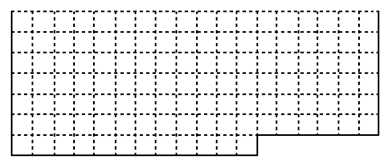
(2)元素甲是第三周期ⅦA族元素,甲元素与另两种非金属元素可组成离子化合物A。写出A的电子式________。
(3)在所有的气态氢化物中,元素乙的氢化物最稳定,写出元素乙的单质与水反应的化学方程式 。
(4)金属元素丙与两种非金属元素形成的化合物溶液常用于检验CO2,则元素丙的简单离子与元素甲的简单离子的半径大小关系是 (用离子符号表示),元素丁的原子序数比丙小8,写出元素丁的单质在CO2中燃烧的化学方程式 。
(5)元素戊是第三周期中简单离子半径最小的元素,写出该元素的最高价氧化物对应水化物的电离方程式 。
(1)如果反应物所具有的总能量大于生成物所具有的总能量,反应物转化为生成物时 (填吸收或放出)热量,△ H (填大于或小于)0;
(2)对于反应2SO2 + O2 2SO3其它条件不变,只改变一个反应条件,将生成SO3的反应速率的变化填入表中空格里 。(填字母 A.增大 B.减小 C.不变)
2SO3其它条件不变,只改变一个反应条件,将生成SO3的反应速率的变化填入表中空格里 。(填字母 A.增大 B.减小 C.不变)
| 改变条件 |
速率变化 |
||
| 降低温度 |
|
||
| 增大O2的浓度 |
|||
| 使用V2O5做催化剂 |
|||
| 压缩气体 |
已知A、B、C、D为第三周期元素,其原子的第一至第四电离能如下表所示:(单位:kJ/mol),回答下面各题:
| 元素代号 |
I1 |
I2 |
I3 |
I4 |
| A |
2080 |
4000 |
6100 |
9400 |
| B |
500 |
4600 |
6900 |
9500 |
| C |
740 |
1500 |
7700 |
10500 |
| D |
580 |
1800 |
2700 |
11600 |
(1)A是 B是 C是 D是 (填元素符号)
(2)B通常显 价,B的电负性 C的电负性(填“>”、“<”或“=”)。
(3)元素C的第一电离能比D高的原因是___________________________
(4)下列元素中,化学性质和物理性质最像A元素的是 。
A.氦(1s2) B. 铍(1s22s2) C. 锂(1s22s1) D. 氢(1s1)
(5)每种元素都出现相邻两个电离能的数据相差较大的情况,请你估计B的第2次电离能飞跃数据将是第___电子。
氮化硅是一种高温陶瓷材料,它的硬度大、熔点高、化学性质稳定。工业上普遍采用高纯硅与纯氮在1300℃反应获得氮化硅。
(1)根据性质,推测氮化硅属于________晶体。
(2)根据化合价规律,推测氮化硅的化学式为_________。
(3)现用四氯化硅和氮气、氢气加强热反应,可得较高纯度的氮化硅,反应的化学方程式为______ ___________。
某些化学键的键能如下表(kJ·mol—1):
(1)根据上表数据判定,H2和Cl2较稳定的是 ;
(2)1 mol H2在足量C12中燃烧,放出热量 kJ。
简答题:
(1)蒸馒头时,经常往面粉中放入小苏打,使得馒头膨松,食用起来香甜可口,请写出其原因:
(2)不能用手拿钠的原因:
(3)常温下,浓硫酸、浓硝酸可以用铝槽车运载的原因: