把5.1 g铝镁合金的粉末放入100 mL某盐酸中,恰好完全反应得到标准状况下氢气5.6 L。试计算:(写出计算过程)
(1)该盐酸的物质的量浓度;
(2)该合金中铝的质量分数。
将某温度下的KNO3溶液200 g蒸发掉10 g水,恢复到原温度,或向其中加入10 g KNO3固体,均可使溶液达到饱和。试计算:
(1)该温度下KNO3的溶解度。
(2)原未饱和溶液中溶质的质量分数。
在标准状况下,SO2和O2混合气体500 mL,通过灼热V2O5层后,体积变为450 mL(恢复到原状况),将此450 mL气体通过足量NaOH溶液后,溶液增重0.985 g,求原混合气体中SO2的质量。
在150 mL 0.2 mol·L-1硫酸铜溶液中插入两个电极,通电电解(不考虑水的电解),则:
(1)若两极均为铜片,试说明电解过程中Cu2+浓度将怎样变化。_____________________。
(2)若阳极为纯锌,阴极为铜片,阳极的电极反应式是______________________________。
(3)如不考虑H+在阴极上放电,当电路中有0.04 mol e-通过时,阴极增重________g,阴极上的电极反应式是___________________________。
1 mol的某有机物甲在O2中充分燃烧,可得到相同条件下等体积的CO2和H2O(g),并消耗112L(标准状况)O2;又知甲的相对分子质量小于100,1 mol甲在酸性条件下可水解生成1 mol乙和1 mol丙,且丙通过一定途径可转化为乙。
(1)甲的分子式为 。
(2)与甲分子式、所属物质类别都相同的有机物的同分异构体有 种(不含甲)。
|
已知:①ROH+HBr(氢溴酸)→ RBr+H2O
|
|
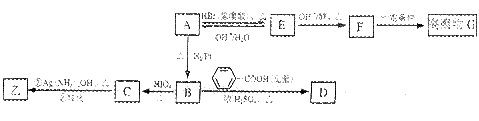 A与甲为同分异构体,且A中含有碳氧双键,B只生成C,与A相关的反应如下:
A与甲为同分异构体,且A中含有碳氧双键,B只生成C,与A相关的反应如下: