某化学兴趣小组回收利用废旧干电池。
实验1 回收填料中的二氧化锰和氯化铵
查阅资料:废旧干电池填料的主要成分为二氧化锰、炭粉、氯化铵和氯化锌等,其中氯化铵、氯化锌可溶于水。兴趣小组的同学们设计回收物质的流程如图1所示。
(1)操作1和操作2的名称都是___________,该操作中玻璃棒的作用是__________。
(2)灼烧滤渣l的目的是____________________________。
实验2利用外壳回收物锌制取氢气及相关探究
(3)用锌和稀硫酸制取氢气。己知氢气密度比空气小且难溶于水,提供装置如图2。
①应选择:发生装置为____(填编号),排空气法收集装置为____(填编号)。
②若用排水法收集并测定气体的体积,气体从装置B导管口接____(填“a”或“b”) 进;选用仪器F测量排出水的体积,仪器F名称是___________________。
(4)探究影响锌与稀硫酸反应快慢的因素。反应过程中,用前10min内收集的氢气体积比较反应的快慢。控制其他条件相同,进行下表四组实验,获得数据如下表。
| 验实号编 |
试 剂 |
前 10min 内产生的氢气体积(mL) |
|
| 不同纯度的锌 |
不同体积和浓度的稀硫酸 |
|
|
| a |
纯锌 |
30mL 30% |
564.3 |
| b |
含杂质的锌 |
30mL 30% |
634.7 |
| c |
纯锌 |
30mL 20% |
449.3 |
| d |
纯锌 |
40mL 30% |
602.8 |
①比较实验a和实验b,可以得到的结论是__ __。
②为了研究硫酸浓度对反应快慢的影响,需比较实验___ _和实验____(填编号).
③控制其他条件相同,需控制的条件是__ __(列举一种条件即可)。
某实验小组取用生石灰时,发现装满生石灰的塑料试剂瓶已经膨胀破裂,于是小组中的几位同学对其中的成分进行了探究。
【提出猜想】小丹认为含有CaO、Ca(OH)2、CaCO3;
小凯认为含有CaO、Ca(OH)2;
小欣认为含有Ca(OH)2、CaCO3。
【设计实验】
| 实验操作 |
实验现象 |
结论 |
|
| 步骤一 |
取试样于试管中加水振荡 |
液体浑浊,用手摸试管外壁,感觉不发热 |
_________________ |
| 步骤二 |
向步骤一的试管中滴加无色酚酞溶液 |
溶液变红色 |
_________________ |
| 步骤三 |
____________________________ |
试管内有气泡生成 |
一定含有CaCO3 |
【得出结论】(1)通过以上探究可知_________同学的猜想正确,
请写出使CaO变质的化学方程式。
【注意:若答对第(2)小题奖励4分,化学试卷总分不超过60分。】
【拓展】(2)如果生石灰已全部变质为碳酸钙,请你设计实验加以证明(写出必要的步骤、现象和结论)。_________________________________________________________________
_________________________________________________________________
_________________________________________________________________
某研究性学习小组设计了测定纯碱(Na2CO3)样品(只含NaCl杂质)中Na2CO3质量分数的实验方案.请回答下列问题:
小资料:碱石灰的主要成分是氢氧化钠和氧化钙的混合物
(1)气体法。
【原理思路】利用Na2CO3与稀硫酸反应产生CO2,通过测量丙装置实验前后的质量得出CO2质量,从而计算碳酸钠的质量分数。(不考虑原装置内空气的影响)
【实验分析】小科同学根据以上思路,设计了如图实验装置。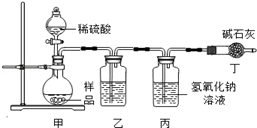
①实验装置乙中盛放的试剂为,其作用是;
装置丁中碱石灰的作用是。(填字母)
A.吸收Na2CO3与稀硫酸反应产生CO2
B.防止外界空气中二氧化碳进入丙中
C.干燥二氧化碳
②实验中如果滴加稀硫酸的速度过快,会导致测得样品中碳酸钠的质量分数(填写“偏高”、“偏低”或“不变”).
③小明同学认为小科的方案存在问题,不考虑原装置内空气的影响,即使操作规范,但由于生成的CO2在装置中残留,也会造成测得结果(填写“偏高”、“偏低”或“不变”),应该将装置甲中双孔橡胶塞换成三孔橡胶塞,并增加下图装置,实验结束后缓缓通入一段时间空气,目的是,其中图中NaOH溶液的作用是。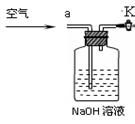
(2)沉淀法.
【实验原理】利用碳酸根离子与钙离子结合生成沉淀,通过沉淀的质量而得出碳酸钠的质量分数。
【实验步骤】①用托盘天平称取样品11.0g放入烧杯中,加水使其完全溶解;
②加入过量的CaCl2溶液充分反应。证明CaCl2过量(即让样品中Na2CO3完全反应)的方法是:静置,向上层清液中滴加溶液,如果没有白色沉淀生成,证明CaCl2过量;
③过滤、洗涤、干燥、称量沉淀的质量为10.0g,由于沉淀表面粘附滤液,不经洗涤就烘干,称量沉淀的质量将会(填写“偏高”、“偏低”或“不变”)。
④通过以上提供的数据计算出样品中碳酸钠的质量分数。(写出计算过程,结果保留至0.1%,共3分,只写出化学方程式给1分)
、现实验室有一瓶久置的NaOH溶液,为检验其是否变质,溶液中的溶质是什么,九(五)班同学设计实验并进行验证。
【提出问题】待测液中的溶质是什么?
(1)请你用化学方程式写出NaOH溶液变质的原因:
【提出猜想】
(2)猜想一:NaOH,猜想二:Na2CO3,猜想三:
【设计方案】
(3)实验方案(一):取少量待测溶液于试管中,向其中滴加无色酚酞溶液,若溶液变红,则说明该待测溶液没有变质,猜想一正确。
请你判断该方案是否合理,理由是。
实验方案(二):取少量待测溶液于试管中,向其中滴加几滴稀盐酸,若溶液中没有出现气泡,则说明该待测溶液没有变质了,猜想一正确。小陈同学认为该结论不合理,请你想一想他的理由。
实验方案(三):取少量待测溶液于试管中,先向其中加入足量的澄清石灰水,再加入无色酚酞,若观察到先有白色沉淀产生,后溶液变红的现象,则说明猜想三正确。请你写出发生的方程式。小刘同学提出异议,原因是。
实验方案(四):取少量待测溶液于试管中,先向其中加入足量的BaCl2溶液,再加入无色酚酞,若观察
到现象,则说明猜想三正确。
【实验结论】该溶液为部分变质的NaOH溶液。
【反思交流】CO2与NaOH溶液反应没有明显现象,除了选用试剂验证产物碳酸钠的存在能证明两者可以反应外,是否有其他办法证明两者反应呢?
(4)下列四种实验设计,实验中其现象不足以说明CO2与NaOH溶液发生了反应的是。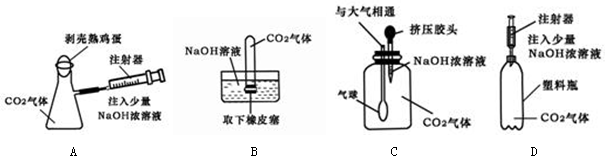
某化学兴趣小组对“NaOH溶液与稀盐酸是否恰好完全反应”进行探究。请你参与他们的探究活动,并回答有关问题。
(实验探究)(1)方案一:某同学按下图所示的方法先向试管中加入约2mL NaOH溶液,再滴入几滴酚酞溶液,溶液变红。然后慢慢滴入稀盐酸,边滴边振荡,直至溶液恰好变为色,证明NaOH溶液与稀盐酸恰好完全反应。
①请指出下图操作中的错误。
②写出NaOH溶液与稀盐酸反应的化学方程式。
(2)方案二:
| 实验步骤 |
实验现象 |
结论 |
| 取2mL NaOH溶液于试管中,滴入一定量的稀盐酸,振荡后加入镁条 |
若 |
稀盐酸过量 |
| 若没有明显现象 |
NaOH溶液与稀盐酸恰好完全反应 |
(实验反思)(3)方案一在滴入稀盐酸的过程中,若观察到曾有少量气泡出现,请分析产生气泡的原因可能是(写出一条即可)。
(4)有同学提出方案二不能证明NaOH溶液与稀盐酸恰好完全反应,其原因是。为此,还需要选择(填一种试剂),再进行实验即可。
(拓展应用)(5)请举一例说明中和反应在生产生活中应用。
实验室有一瓶长期暴露在空气中的氢氧化钠固体样品,观察发现,样品表面有白色粉末。某兴趣小组的同学对该样品的成分及含量进行了探究。
【提出问题】该样品中含有哪些物质?
【提出猜想】通过分析,提出如下猜想:
猜想Ⅰ:已完全变质,该样品中只含Na2CO3;
猜想Ⅱ:部分变质,该样品中含有NaOH和Na2CO3。
则NaOH变质反应的化学方程式为________________________________;
【查阅资料】
碱性的Na2CO3溶液可以与中性的CaCl2溶液发生复分解反应;
【实验探究】为确定该样品的成分,小明设计了如下实验方案,请你一起完成下列实验报告。
| 实验操作 |
实验现象 |
实验结论 |
| (1)取少量样品溶于水,加入 ; |
白色沉淀产生 |
(2)该反应的化学方程式为 |
| (3)将上述反应后的混合液过滤,取滤液加入 ; |
(4) |
证明猜想Ⅱ成立。 |