请用适当的化学用语填空。
(1)Na2CO3水解的离子方程式: ;
(2)H2S电离方程式: ;
(3)AlCl3水解的离子方程式: ;
(4)在25℃、101 kPa下,l g甲烷完全燃烧生成CO2和液态水时放热55.6 kJ热量,写出表示甲烷燃烧热的热化学方程式: ;
(5)碱性氢氧燃料电池的两极电极方程式
负极: ;
正极: 。
(6)写出NaHCO3溶液中的离子浓度关系
c(H+)+c(Na+)= ;
c(Na+)= 。
碳单质在工业上有多种用途。例如焦炭可用来制取水煤气、冶炼金属,活性炭可处理大气污染物NO。
一定条件下,在2 L密闭容器中加入NO和活性炭(无杂质)反应生成气体A和B。当温度在T1℃时,测得各物质平衡时物质的量如下表:
| 活性炭 (mol) |
NO (mol) |
A (mol) |
B (mol) |
|
| 初始 |
2.030 |
0.100 |
0 |
0 |
| 平衡 |
2.000 |
0.040 |
0.030 |
0.030 |
(1)在T1℃时,达到平衡共耗时2分钟,则NO的平均反应速率为mol/(L·min);当活性炭消耗0.015mol时,反应的时间(填“大于”、“小于”或“等于”)1分钟。
(2)在T1℃下反应达到平衡后,下列措施不能改变NO的转化率的是。
a.增大活性炭的量 b.增大压强 c.升高温度 d.移去部分B
(3)结合上表数据,该反应的平衡常数表达式为。(生成物A、B用相应的化学式表示)若T1℃时的平衡常数为K1,T2℃时的平衡常数为K2,且K1>K2,能否判断该反应是吸热反应还是放热反应,说明理。
重铬酸钠俗称红矾钠(Na2Cr2O7·2H2O)是重要的化工产品和强氧化剂。工业上通过煅烧铬铁矿制取,其反应如下:
反应Ⅰ 4Fe(CrO2)2+8Na2CO3+7O2 → 2Fe2O3+8Na2CrO4+8CO2
反应Ⅱ 2CrO42- + 2H+ → Cr2O72- + H2O
反应Ⅲ 3CrO42- + 4H+ →Cr3O102- + 2H2O(副反应)
(1)上述反应中不属于氧化还原反应有个。已知Fe(CrO2)2中铬元素是+3价,关于反应Ⅰ的下列说法中正确的是。
a.被氧化的元素只有+3的Cr,被还原的元素只有0价的O
b.氧化剂与还原剂的物质的量之比为4:7
c.每生成1molCO2,转移3.5mol电子
d.每摩尔+3的Cr能还原0.75mol氧气
(2)+6价铬的毒性很强,制取红矾钠后的废水中含有的Cr2O72-,可以用绿矾除去。测得反应后的溶液中含Cr3+、Fe2+、Fe3+、H+等阳离子。写出该反应的离子方程式并标出电子转移的方向和数目:。
(3)某厂废水中含1.00×10−3mol/L的Cr2O72-,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4 (Cr的化合价为+3,Fe的化合价依次为+3、+2)。欲使1L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4。理论上需要加入g FeSO4·7H2O。
化学的魅力之一来自于许许多多的“最”。例如熔点最高的金属是钨,硬度最大的金属是铬,密度最大的金属是锇……。根据下面的“最”回答问题:
(1)空气中含量最多的元素与原子核外电子数最少的元素组成的简单物质的电子式,该分子属
于(填“极性”或“非极性”)分子。
(2)海水中含量最多的四种元素,除了O、H外,另外二种元素的原子半径由大到小的顺序
(填元素符号),其中任意三种元素组成的物质中肯定含有的化学键是键。
(3)就物理性质而言,第二周期原子序数最小的元素的单质是最小的金属,其相邻元素R的化学性质与地壳中含量最多的金属元素的化学性质相似,写出R的最高价氧化物对应水化物与NaOH溶液反应的化学方程式:。
(4)关于人体内含量最多的元素M和最硬非金属单质的组成元素N的说法中,正确的是。
a.M和N组成的物质中,M显负价,故M的非金属性强于N
b.M的氢化物的熔沸点必定比N的氢化物的熔沸点高
c.M原子的核外电子云形状种类比N原子的核外电子云形状种类要多
d.M原子的核外未成对电子数和N原子的核外未成对电子数目相等
6-羰基庚酸是一种重要的化工中间体,下面合成它的流程图:
已知: 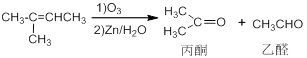
(1)反应①的条件是,反应类型是。
(2)下列说法中正确的是:
a.1molC与足量的Na反应生成1molH2 b.C能被催化氧化成酮
c.Ni催化下1molG最多只能与1molH2加成 d.F能发生消去反应生成两种不同烯烃
(3)E与新制Cu(OH)2反应的化学方程式为。
(4)G的同分异构体有多种。请写出结构中含有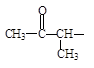 、且属于酯类的同分异构
、且属于酯类的同分异构
体:、、。
(5)已知“Diels-Alder反应”为: 。,
。,
物质D与呋喃(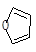 )也可以发生“Diels-Alder反应”,该化学反应方程式为:
)也可以发生“Diels-Alder反应”,该化学反应方程式为:
。
已知:有机物D( )是组成人体蛋白质的氨基酸之一,它可由A通过以下反应合成制取。有机物A(
)是组成人体蛋白质的氨基酸之一,它可由A通过以下反应合成制取。有机物A(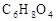 )为食品包装中的常用防腐剂,常温下难溶于水, 可以使溴水褪色。有机物B(
)为食品包装中的常用防腐剂,常温下难溶于水, 可以使溴水褪色。有机物B(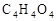 ),其分子中没有支链,通常状况下为无色晶体,能与氢氧化钠溶液发生反应。
),其分子中没有支链,通常状况下为无色晶体,能与氢氧化钠溶液发生反应。
请回答下列问题: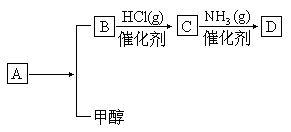
(1)B、D的结构简式分别是______________________、__________________________。
(2)A可以发生的反应有__________(选填序号)
①加成反应②氧化反应③酯化反应④加聚反应
(3)B分子中所含的官能团名称是______________________________。
(4)B的具有相同官能团的同分异构体的结构简式是______________________________。
(5)写出由B与甲醇反应制A的化学方程式是____________________________________。
___________________________________________________________。