Ⅰ.沿海地区有着丰富的海水资源,海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子。合理利用资源和保护环境是可持续发展的重要保证。 (1)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料。试写出电解熔融氯化镁制取金属镁的化学反应方程式 。
(1)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料。试写出电解熔融氯化镁制取金属镁的化学反应方程式 。
(2)某化工厂生产过程中会产生含有Cu2+和Pb2+的污水。排放前拟用沉淀法除去这两种离子,根据下列数据,你认为投入 (选填“Na2S”或“NaOH”)效果更好。
| 难溶电解质 |
Cu(OH)2 |
CuS |
Pb(OH)2 |
PbS |
| Ksp |
4.8×10-20 |
6.3×10-36 |
1.2×10-15 |
1.0×10-28 |
(3)火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题。利用海水脱硫是一种有效的方法,其工艺流程如下图所示:
①天然海水的pH≈8,试用离子方程式解释天然海水呈弱碱性的原因 (任写一个)。
②某研究小组为探究提高含硫烟气中SO2吸收效率的措施,进行了天然海水吸收含硫烟气的模拟实验,实验结果如图所示。
请你根据图示实验结果,就如何提高一定浓度含硫烟气中SO2的吸收效率,提出一条合理化建议: 。
③天然海水吸收了含硫烟气后会溶有H2SO3、HSO3-等分子或离子,使用氧气将其氧化的化学原理是 (任写一个化学方程式或离子方程式)。氧化后的“海水”需要引入大量的天然海水与之混合后才能排放,该操作的主要目的是 。
Ⅱ.能源是人类生存和发展的重要支柱。研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义。已知下列热化学方程式
①2H2(g)+O2(g)=2H2O(l)  H=-570kJ/mol;
H=-570kJ/mol;
②H2(g)+1/2O2(g)=H2O(g)  H=-242kJ/mol;
H=-242kJ/mol;
③C(s)+1/2O2(g)=CO(g)  H=—110.5kJ/moL;
H=—110.5kJ/moL;
④C(s)+O2(g)=CO2(g)  H=—393.5kJ/moL;
H=—393.5kJ/moL;
⑤CO2(g)+2H2O(g)=2CH4(g)+2 O2(g)  H=+890kJ/moL
H=+890kJ/moL
回答下列问题
(1)上述反应中属于吸热反应的是 。
(2)H2的燃烧热为△H= 。
(3)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然难直接测定,但可通过间接的方法求得。已知C(s) + H2O(g)=H2(g)+ CO(g)  H=akJ/moL;则a= ;该反应的熵
H=akJ/moL;则a= ;该反应的熵 S 0(选填“>”、“=”、“<”);已知自由能
S 0(选填“>”、“=”、“<”);已知自由能 G=
G= H—T
H—T S,当
S,当 G<0时可自发进行。则该反应在什么条件下可自发进行__________________。
G<0时可自发进行。则该反应在什么条件下可自发进行__________________。
(4)CO分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法错误的是 。
A.负极的电极反应式为:CO+O2—―2e-=CO2
B.工作时电极b作正极,O2—由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高
A、B、C、D、E、F六种化合物,其中A、B、C、D、E均由短周期元素组成,焰色反应均为黄色,B、C、E均由三种元素组成。B、C的组成元素相同,且C的摩尔质量比B大80g/mol,回答:
(1)固体化合物A为浅黄色粉末,该化合物中含有的化学键为 。
A、离子键B、极性共价键C、非极性共价键 D、氢键
(2)下表为B与F实验的部分内容
| ①在含B的溶液中加入稀H2SO4,产生浅黄色浑浊和使澄清石灰水变浑浊的无色有刺激性气味的气体 |
| ②20mL沸水中滴加F的饱和溶液1~2mL所得液体呈红褐色 |
| ③将实验②得到的红褐色液体加热蒸发,灼烧,最终得到红棕色固体 |
写出B与稀H2SO4反应的离子方程式___________,写出②中离子反应方程式__________。
(3)现由6种粒子Mn2+、MnO4-、H+、H2O、X2Y82-(C中含有的阴离子),XY42-完成一个离子方程式,已知Mn2+为还原剂,得到1mol MnO4-需氧化剂的物质的量为 mol。
(4)化合物D和E相互转化D E,若有D和E·
E,若有D和E· H2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增生2.20g,则E·xH2O的化学式为 。
H2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增生2.20g,则E·xH2O的化学式为 。
查资料得:HNO2是一种弱酸且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。
试回答下列问题:
(1)下列方法中,不能用来区分NaNO2和NaCl的是________(填序号)。
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI—淀粉溶液来区别
D.用AgNO3和HNO3两种试剂来区别
(2)Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是________(填序号)。
A.Cl2B.FeC.H2O2D.HNO3
(3)某同学把酸性高锰酸钾溶液滴入NaNO2溶液中,观察到紫色褪去,同时生成NO3-和Mn2+,请写出反应的离子方程式:_________________。
(4)已知FeSO4在一定条件下可转变为高铁酸钾(K2FeO4),高铁酸钾是一种新型、高效的绿色水处理剂,在水中发生反应生成氢氧化铁胶体。高铁酸钾作为水处理剂发挥的作用是____________。
某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大。元素A、B、C、D、E的原子结构等信息如下:
| 元素 |
元素性质或原子结构 |
| A |
周期表中原子半径最小 |
| B |
原子核外有三种不同的能量的原子轨道且各个轨道所填充的电子数相同 |
| C |
最外层p轨道半充满 |
| D |
位于短周期,其原子的核外成对电子数是未成对电子数的3倍 |
| E |
位于ds区且原子的最外层电子数与A的相同 |
请回答下列问题(用A、B、C、D、E所对应的元素符号作答):
(1)B、C、D第一电离能由小到大为______________。
(2)E的二价离子的电子排布式为______________。
(3)A2B2D4是一种有机羧酸,常用作除锈剂,该分子中B的杂化方式为____________;1 mol A2B2D4分子中含有σ键数目为____________。
(4)与化合物BD互为等电子体的阴离子化学式为__________(任写一种)。
(5)B2A6、C2A4分子中均含有18个电子,它们的沸点相差较大,主要原因是__________________。
(6)BD2在高温高压下所形成晶体的晶胞如右图所示。一个该晶胞中含________个D原子。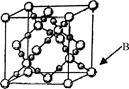
碱式氧化镍(NiOOH)可用作镍氢电池的正极材料。以含镍(Ni2+)废液为原料生产NiOOH的一种工艺流程如下:
(1)加入Na2CO3溶液时,确认Ni2+已经完全沉淀的实验方法是 。
(2)已知Ksp[Ni(OH)2]=2×10-15,欲使NiSO4溶液中残留c(Ni2+)≤2×10-5 mol·L-1,调节pH的范围是 。
(3)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式: 。
(4)若加热不充分,制得的NiOOH中会混有Ni(OH)2,其组成可表示为xNiOOH·yNi(OH)2。现称取9.18 g样品溶于稀硫酸,加入100 mL 1.0 mol·L-1 Fe2+标准溶液,搅拌至溶液清亮,定容至200 mL。取出20.00 mL,用0.010 mol·L-1 KMnO4标准溶液滴定,用去KMnO4标准溶液20.00 mL,试通过计算确定x、y的值(写出计算过程)。涉及反应如下(均未配平):
NiOOH+Fe2++H+—Ni2++Fe3++H2O Fe2++MnO4-+H+—Fe3++Mn2++H2O
对碳及其氧化物的化学热力学、动力学研究有助于人类充分利用化石燃料,消除氧化物对环境的负面影响。
(1)25℃时,石墨和CO的燃烧热分别为:393.5kJ/mol、283.0kJ/mol。请写出石墨不完全燃烧时的热化学方程式 。
(2)25℃时,反应2CO2(g)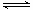 2CO(g)+ O2(g)的平衡常数K=2.96×10-92。在一个体积可变的密闭容器中(起始时容器体积为1L)充入一定量CO2、CO、O2的混合气体,要使容器中的反应开始时向CO2分解的方向进行,起始时三种气体的物质的量浓度应满足的关系是 。当该反应在25℃时达到平衡后,其他条件不变时,升高温度或增加容器的压强,均能使该平衡发生移动,②请在坐标中作出该反应的平衡常数K随温度(T)、压强(p)变化的示意图。
2CO(g)+ O2(g)的平衡常数K=2.96×10-92。在一个体积可变的密闭容器中(起始时容器体积为1L)充入一定量CO2、CO、O2的混合气体,要使容器中的反应开始时向CO2分解的方向进行,起始时三种气体的物质的量浓度应满足的关系是 。当该反应在25℃时达到平衡后,其他条件不变时,升高温度或增加容器的压强,均能使该平衡发生移动,②请在坐标中作出该反应的平衡常数K随温度(T)、压强(p)变化的示意图。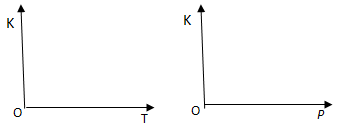
(3)1600℃时,反应2CO(g)+ O2(g)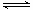 2CO2(g)的平衡常数K=1.0×108。经测定,汽车尾气中CO和CO2气体的浓度分别为4.0×10-5mol/L和4.0×10-4mol/L。若在汽车的排气管上增加一个1600℃时的补燃器,并不断补充O2使其浓度始终保持为4.0×10-4mol/L。则经补燃处理后尾气中CO的浓度为 mol/L(结果保留两位有效数字)。
2CO2(g)的平衡常数K=1.0×108。经测定,汽车尾气中CO和CO2气体的浓度分别为4.0×10-5mol/L和4.0×10-4mol/L。若在汽车的排气管上增加一个1600℃时的补燃器,并不断补充O2使其浓度始终保持为4.0×10-4mol/L。则经补燃处理后尾气中CO的浓度为 mol/L(结果保留两位有效数字)。
(4)以CO和O2为电极燃料,以熔融K2CO3为电解质组成燃料电池,请写出该电池的负极反应式 。