下列各实验相应操作、实验现象及原因解释或推论合理的是
| 选项 |
操作 |
现象 |
解释或推论 |
| A |
铁片投入浓硫酸 |
无明显变化 |
常温下铁不与浓硫酸反应 |
| B |
将浓硫酸滴到白纸上 |
白纸变黑 |
浓硫酸强氧化性导致纸张中的纤维素炭化 |
| C |
二氧化硫通入溴水 |
溴水褪色 |
说明二氧化硫具有漂白性 |
| D |
湿润的PH试纸检验某气体 |
试纸变蓝 |
该气体是氨气 |
关于下列各装置图(略去部分夹持仪器)的叙述中,正确的是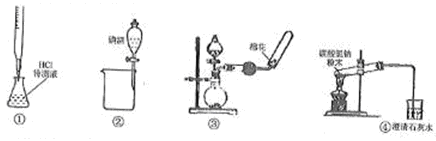
| A.利用装置①进行盐酸待测液浓度的测定 |
| B.利用装置②分离碘酒中碘和酒精 |
| C.利用装置③制备收集干燥氨气 |
| D.利用装置④加热分解碳酸氢钠 |
常温F,下列各组粒子在指定溶液中一定能大量共存的是
| A.FeCl3溶液中:K+、C6H5OH、Br-、NO3一 |
| B.在氨水溶液中Al3+、NO3一、Cl-、 Ag+ |
| C.某透明澄清的溶液中:NH4+、 Fe3+、NO3一、C1- |
| D.能使甲基橙显红色的溶液:K、Cr2O72-、CH3CH2OH、SO42一 |
下列叙述Ⅰ和Ⅱ均正确并有因果关系的是
| 选项 |
叙述I |
叙述Ⅱ |
| A |
Na2CO3溶液可与油污反应 |
用热的烧碱溶液洗去油污 |
| B |
Ba2SO4难溶于酸 |
用盐酸和BaCl2检验Ba2+ |
| C |
NH3能使酚酞试液变红 |
NH3可用于设计喷泉实验 |
| D |
晶体硅熔点高硬度大 |
晶体硅可用于制作半导体 |
短周期元素X、Y、Z、W的原子序数依次增大,X 原子的最外层电子数是其内层电子总数的3 倍,Y 原子的最外层只有2 个电子,Z 单质可制成半导体材料,W与X属于同一主族。下列叙述正确的是
| A.元素X 的简单气态氢化物的热稳定性比W的弱 |
| B.元素W 的最高价氧化物对应水化物的酸性比Z的弱 |
| C.原子半径的大小顺序: rY >rZ >rW >rX |
| D.化合物YX、ZX2、WX3中化学键的类型相同 |
某气态烃1体积只能与1体积HBr发生加成反应,生成溴代烷,此溴代烷1mol可与7mol Cl2发生完全取代反应,则该烃的结构简式为
| A.CH2=CH2 | B.CH3CH=CH2 |
| C.CH3CH3 | D.CH2=CH—CH=CH2 |