向2.0L恒容密闭容器中充人1.0mol PCl5,在温度为T时发生如下反应
PCl5(g)  PCl3(g)+C12(g)
PCl3(g)+C12(g) 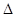 H=124kJ·mol-1。反应过程中测定的部分数据见下表:
H=124kJ·mol-1。反应过程中测定的部分数据见下表:
| 时间t/s |
0 |
50 |
150 |
250 |
350 |
| n(PCL3)/mol |
0 |
0.16 |
0.19 |
0.2 |
0.2 |
回答下列问题
(1)反应在前50 s的平均速率v(PCI5)=________。
(2)温度为T时,该反应的化学平衡常数=________。
(3)要提高上述反应的转化率,可采取的措施有________。
(4)在温度为T时,若起始时向容器中充入0.5mol PCl5和a mol Cl2平衡时PCl5的转化率仍为20%,则a=________。
(5)在热水中,五氯化磷完全水解,生成磷酸(H3 PO4),该反应的化学方程式是________。
若将0.01 mol PCI5投入l L热水中,再逐滴加入AgNO3溶液,先产生的沉淀是________ [已知Ksp(Ag3 PO4)="1.4" x 1 0-16,Ksp(AgCl)="1.8" x 10-10]。
(6)一定条件下,白磷溶于硝酸溶液产生一种氮氧化合物气体,该气体与白磷的物质的量之比为20:3,反应的化学方程式为____________________________。
主族元素W、X、Y、Z的原子序数依次增大,W的原子最外层电子数是次外层电子数的3倍。X、Y和Z分属不同的周期,它们的原子序数之和是W原子序数的5倍。在由元素W、X、Y、Z组成的所有可能的两元素化合物中,由元素W与Y形成的化合物M的熔点最高。请回答下列问题:
(1)W元素原子的L层电子排布式为,W3分子空间构型为;
(2)X单质与水发生主要反应的化学方程式为;
(3)化合物M的化学式为,其晶体结构与NaCl相同,而熔点高于NaCl。M熔点较高的原因是。将一定量的化合物ZX负载在M上可制得ZX/M催化剂,用于催化碳酸二甲酯与月桂醇酯交换合成碳酸二月桂酯。在碳酸二甲酯分子中,碳原子采用的杂化方式有,O—C—O的键角约为;
(4)X、Y、Z可形成立方晶体结构的化合物,其晶胞中X占据所有棱的中心,Y位于顶角,Z处于体心位置,则该晶体的组成为X:Y:Z=;
(5)含有元素Z的盐的焰色反应为 色。许多金属盐都可以发生焰色反应,其原因是。
色。许多金属盐都可以发生焰色反应,其原因是。
第4周期的A、B、C、D四种元素,其价电子数依次为1、2、2、7。其原子序数按A、B、C、D顺序增大,已知A与B的次外层电子数为8,而C与D次外层电子数为18,根据结构填空:
(1)写出元素名称:A,B,C,D。
(2)D的简单离子是。
(3)元素的氢氧化物碱性最强的是。
(4)B与D二原子间能形成化合物的化学式是。
(5)写出A、B的电离能顺序。
(6)写出C基态原子的电子排布式。
X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X、Y的元素符号依次为、;
(2)XZ2与YZ2分子的立体结构分别是和,相同条件下两者在水中的溶解度较大的是(写分子式),理由是;
(3)Q的元素符号是,它属于第周期,它的核外电子排布式为,在形成化合物时它的最高化合价为;
(4)用氢键表示式写出E的氢化物溶液中存在的氢键(任意2 种)。
种)。
下图是表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分。
(1)其中代表金刚石的是(填编号字母,下同)________,金刚石中每个碳原子与________个碳原子最接近且距离相等。金刚石属于________晶体;
(2)其中代表石墨是________,其中每个正六边形占有的碳原子数平均为________个;
(3)其中表示NaCl的是________,每个Na+周围与它最接近且距离相等的Na+有________个;
(4)代表CsCl的是________,它属于________晶体,每个Cs+与________个Cl--紧邻;
(5)代表干冰的是________,它属于________晶体,每个CO2分子与________个CO2分子紧邻;
(6)上述五种物质熔点由高到低的排列顺序为________。
(选做题)某温度时在2L容器中X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。由右图中数据分析: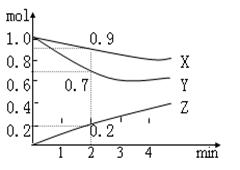
(1)反应开始2min内的X的化学反应速率
(2)该反应的化学方程式为:___________。