研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2 CaO作电解质,利用右图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中正确的是( )
CaO作电解质,利用右图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中正确的是( )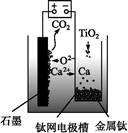
| A.由TiO2制得1 mol金属Ti,理论上外电路转移2 mol电子 |
B.阳极的电极反应为C+2O2--4e- CO2↑ CO2↑ |
| C.在制备金属钛前后,整套装置中CaO的总量减少 |
| D.若用铅蓄电池作该装置的供电电源,石墨电极应连接Pb电极 |
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+。现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如下图所示,下列说法中不正确的是()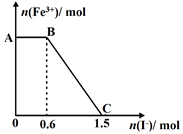
| A.图中AB段的氧化剂为K2Cr2O7 |
| B.图中BC段发生的反应为2Fe3++2I- =2Fe2++I2 |
| C.开始加入的K2Cr2O7为0.25 mol |
| D.K2Cr2O7可与FeSO4反应的物质的量为1:3。 |
下列反应中,相关示意图像错误的是()
| A |
B |
C |
D |
| 将二氧化硫通入到 一定量氯水中 |
将氨水滴入到一定量 氯化铝溶液中 |
将铜粉加入到一定量 浓硝酸中 |
将铁粉加入到一定量氯化铁溶液中 |
 |
 |
 |
 |
下图是可逆反应A+2B  2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断()
2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断()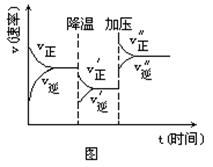
A.正反应是吸热反应 B.若A、B是气体,则D是液体或固体
C.逆反应是放热反应. D.A、B、C、D均为气体
在一密闭容器中,反应aA(g)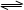 bB(g)达平衡后,保持温度不变,将容器体积减半,当达到新的平衡时,A的浓度增大为原来的1.8倍,则下列说法错误的是( )
bB(g)达平衡后,保持温度不变,将容器体积减半,当达到新的平衡时,A的浓度增大为原来的1.8倍,则下列说法错误的是( )
| A.平衡向正反应方向移动了 |
| B.物质A的转化率增大了 |
| C.恒温恒压时再充入A物质,达到新的平衡时A的质量分数增加了 |
| D.a>b |
甲、乙两个电解池均以Pt为电极且互相串联。甲池盛有AgNO3溶液,乙池盛有一定量的某盐溶液,通电一段时间后,测得甲池阴极质量增加2.16g,乙池电极析出0.24g金属,则乙池中溶质可能是
| A.CuSO4 | B.MgSO4 | C.Al(NO3)3 | D.Na2SO4 |