工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某科研小组用该原理处理污水,设计装置示意图如图所示。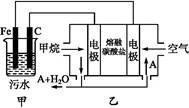
(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时应向污水中加入适量的 。
a.H2SO4 b.CH3CH2OH c.Na2SO4
d.NaOH e.BaSO4
(2)电解池阳极实际发生了两个电极反应,其中一个反应生成一种无色气体,则阳极的电极反应式分别是Ⅰ. ;Ⅱ. 。
(3)该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料作电极。为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见上图)。A物质的化学式是 。
(4)已知燃料电池中有1.6 g CH4参加反应,则C电极理论上生成气体 L(标准状况)。
有机物中,有一些分子式符合通式CnHn,如C2H2、C6H6等。
(1)关于这些有机物的说法中正确的是(选填编号)。
| A.可能互为同系物 | B.在空气中燃烧时火焰明亮且产生黑烟 |
| C.一定能使酸性高锰酸钾溶液褪色 | D.等质量的这些有机物完全燃烧时耗氧量相同 |
(2)写出分子式为C4H4且为链烃的有机物的结构简式,它的一氯代物的同分异构体有种。
(3)写出分子式为C6H6且结构中只有C-C键和C-H键的有机物结构简式:。
(4)某有机物分子式为C8H8,且属于芳香烃,已知它可使酸性高锰酸钾溶液和溴水褪色,则该有机物的结构简式为,写出其发生加聚反应的化学方程式。
(12分) (1)已知丙酮[ CH3COCH3 ]键线式可表示为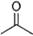 根据键线式回答下列问题:
根据键线式回答下列问题: 分子式:,结构简式:。
分子式:,结构简式:。
(2)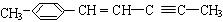 分子中最多有 个原子共直线;最多有个原子共平面。
分子中最多有 个原子共直线;最多有个原子共平面。
(3)写出乙烯分子的电子式:。
(4)有机物(CH3)2CHCH(C2H5)CH=CH2的名称是。
(5)写出甲苯制TNT化学方程式。
(6)  的一氯取代物有种,
的一氯取代物有种, 的二氯取代物有种。
的二氯取代物有种。
(12分)有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属。三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有标出)。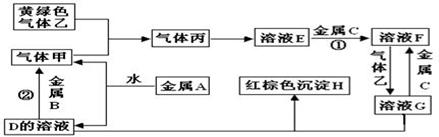
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:
A_____________;H ______________; G___________;乙____________。
(2)写出下列反应的化学方程式:
反应①___________________________________________________________;
反应②___________________________________________________________。
(8分)甲、乙、丙三种物质之间有如下转化关系:
(1)若甲是不溶于水的白色固体物质,既能溶于盐酸又能溶于氢氧化钠溶液,则甲是
________ ;写出 乙→丙转化的化学方程式 :___________________________。
(2)若乙溶液中加入KSCN溶液,有红色出现,则甲物质是___________;写出 甲→乙转化的离子方程式_________________________________________。
(12分)以下表格中的实验是以CuSO4为例,分析电解质在溶液里所起反应的实质