(1)从NaCl、CuSO4两种电解质中选取适当的物质,按电解要求填写(填化学式):
①以铜为电极,进行电解时电解质浓度不变,则采用的电解质是__________。
②以碳棒为电极,进行电解时使电解质和水的质量均变小,则采用的电解质是________。
此电解反应的阳极反应式: ,电解池的总反应化学方程式: 。
(2)①甲同学用直流电源、碳棒、铜棒和稀硫酸为原材料,实现了在通常条件下不能发生的反应:Cu+H2SO4(稀)===CuSO4+H2↑,则该同学选用的阳极材料是_______。
②乙同学在做铜与稀硫酸的上述反应实验时,看到碳棒和铜棒上都有气泡产生,但铜棒却没有被腐蚀。请你选出最可能的原因 (填字母代号)
A.铜被稀硫酸钝化 B.碳棒和铜棒与电源正负极接反
此时的电解池的总反应为____________ ____________
(8分)在下列各组物质中,找出合适的序号填在对应的空格内:
①NO2和N2O4 ②12C和14C ③
④
⑤ ⑥甲烷与丙烷
⑥甲烷与丙烷
⑦乙醇(CH3CH2OH)和乙二醇(HO—CH2—CH2—OH)
注意:以上七组物质,不一定是每组物质都能找到对应填空
⑴互为同位素的是 ▲ ;⑵互为同分异构体的是 ▲ ;
⑶互为同系物的是 ▲ ;⑷同一种物质的是 ▲ 。
已知蓝铜矿的主要成分是2CuCO3·Cu(OH)2,受热易分解。铝土矿的主要成分是Al2O3、Fe2O3、SiO2。经过一定条件的转化二者均可转化为金属单质,根据下列框图转化回答问题: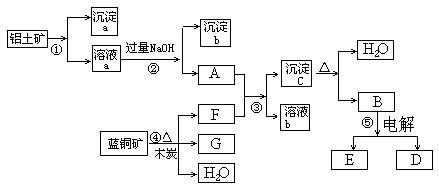
(1)写出①的离子方程式:______________________、_____________________。
(2)经过④、⑤步反应得到铜和金属铝,写出反应的化学方程式:
_____________________、______________________。
(3)若过量F与A反应,溶液b的成分是:______(写化学式)。
有机物A(C6H8O4)为食品包装纸的常用防腐剂。A可以使溴水褪色。A难溶于水,但在酸性条件下可发生水解反应,得到B(C4H4O4)和甲醇。通常状况下B为
无色晶体,能与氢氧化钠溶液发生反应。
(1)A可以发生的反应有(选填序号)。
① 加成反应 ② 酯化反应 ③ 加聚反应 ④ 氧化反应
(2)B分子中没有支链,其结构简式是
(3)由B制取A的化学方程式是。
如图所示,利用海洋可提取很多重要的化工原料。
A、B、C、D、E、F、G都是短周期元素,原子序数依次增大,B、C、D同周期,A、E同主族,D、G同主族。A、C能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1。B元素原子有两个未成对电子,D是周期表中电负性最大的元素,F是地壳中含量最多的金属元素。根据以上信息回答下列问题:
(1)写出A、C、E三种元素的符号:
A, C, E。
(2)甲、乙两分子中含有非极性共价键的是(填分子式)。
(3)C、D、F的离子中,半径最小的是(填离子符号)。.
(4)在气态单分子化合物FG3中元素F的杂化方式为:杂化,FG3的空间构型为。
空气质量高低直接影响着人类的生产和生活,它越来越受到人们的关注。被污染的空气中杂质的成分有多种,其中计入《空气质量日报》空气污染指数的项目有SO2、CO、NO2、O3和可吸入颗粒物等。
请回答下列问题:
(1)S、N、O的第一电离能由大到小的顺序为。
(2)血红蛋白中含有Fe2+,CO易与血红蛋白结合成稳定的配合物而使人中毒。
①写出亚铁离子的基态电子排布式。
② CO有多种等电子体,其中常见的两种为。CO结构中σ键和П键数目之比为。
③Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 ___________(填晶体类型),Fe元素的化合价。
(3)SO2是一种大气污染物,为减轻SO2污染,火力发电厂生产中常在燃煤中加入CaO以“固硫”。 CaO晶胞如右图所示,其中Ca2+周围的阴离子配位数为,CaO晶体和NaCl晶体中离子排列方式相同,其晶格能分别为:CaO:3401kJ/mol、NaCl:786kJ/mol。CaO晶体的熔点NaCl晶体的熔点(填“高于”、“等于”或“低于”),导致两者晶格能差异的主要原因是。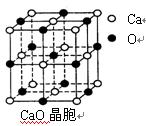
(4)随着人们生活质量的提高,不仅室外的环境安全为人们所重视,室内的环境安全和食品安全也越来越为人们所关注。甲醛是室内主要空气污染物之一(其沸点是-19.5 ℃),甲醇是“假酒”中的主要有害物质(其沸点是64.65 ℃),甲醇的沸点明显高于甲醛的主要原因是:。