硫酸生产中,SO2催化氧化成SO3的热化学方程式为:
2 SO2 (g)+ O2(g) 2 SO3(g) △H =" —196.0" kJ.mol-1
2 SO3(g) △H =" —196.0" kJ.mol-1
①容器体积不变时,为了提高SO2的转化率,可采用的措施是_____(填字母标号)。
| A.加入V2O5做催化剂 | B. 使用过量SO2 使用过量SO2 |
C.高温 | D.通入过量空气 |
②某温度时,在一个容积为10L的密闭容器中充入4.0mol SO2和2.0molO2,半分钟后达到平衡,并放出352.8 kJ的热量。此时SO2的转化率是_____,该温度下的平衡常数K===_____________。(每空3分)
在2SO2+O2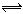 2SO3的反应里,开始SO2和O2的浓度均为0.5mol/L,2分钟后测得SO2的浓度为0.25mol/L,则
2SO3的反应里,开始SO2和O2的浓度均为0.5mol/L,2分钟后测得SO2的浓度为0.25mol/L,则 =_____________________,各物质所表示的反应速率的最简整数比
=_____________________,各物质所表示的反应速率的最简整数比 :
: :
: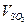 =_________
=_________
化学反应速率用时间内或的的变化来表示。在容积不变的反应器中,通常是用时间内反应物浓度的或生成物浓度的来表示,即表达式,化学反应速率常用的单位有。
按要求书写下列方程式并填写反应类型(12分):
实验室制取氧气(任写一种)反应类型
实验室制取二氧化碳反应类型
氢气还原氧化铜反应类型
铁在氧气中燃烧反应类型
包括3小题,(共10分)
(1)1mol H2SO4中约含有个H2SO4,mol H ,mol O
(2)9.03×1023个CO2的物质的量是mol,在标准状况下的体积L,质量是是克。
(3)在100mL2mol/LH2SO4溶液中,H2SO4的质量是克。H+的物质的量浓度为。
(4)质量分数为36.5%、密度为1.18g/cm3的浓盐酸中HCl的物质的量浓度为。
(共5分)分离沸点不同但又互溶的液体混合物,常用的方法是 ;分离固液混合物的常用的方法是 ;分离两种溶解度相差很大的溶质的溶液时,常用的方法是;萃取的条件是 。