(1)用离子方程式表示下列应用或现象
② 小苏打与烧碱溶液的反应
②稀硫酸与氢氧化钡的反应 
(2)根据下列离子方程式,各写一个符合条件的化学方程式
①Ag++Cl-=AgCl↓
②CO32─+ 2H+=CO2↑+ H2O
Ⅰ.在t℃时,某NaOH稀溶液中,c(H+)=10-a mol/L,c(OH-)=10-b mol/L,
已知a+b=12,则:
该温度下,水的离子积常数Kw=。
该温度下,将10mL 0.1mol/L的稀硫酸与10mL 0.4mol/L的NaOH溶液混合后,溶液的pH=,此时该溶液中由水电离的c(OH-)=mol/L。(忽略体积变化)
Ⅱ. 根据2CrO42-(黄)+2H+ =Cr2O72-(橙)+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,电解一段时间后,右边溶液逐渐由黄色变为橙色。图中右侧电极连接电源的极,其电极反应式为,通电完成后,若转移0.1mol电子,则阴极区和阳极区的质量差为g。(已知电解前两极区溶液质量相同)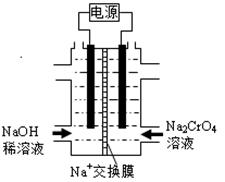
(18分)A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A元素的原子只有一个电子层,又知A与C、B与D分别是同一主族的元素,B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数之和的二倍,又知四种元素的单质常温常压下有两种气体、两种固体。请回答下列问题:
(1)D元素在周期表中的位置,由A、B两种元素可形成E、F两种化合物,写出其中一种化合物分解生成另一种化合物的化学方程式:,反应物的电子式是。其所含化学键为。
a.离子键 b.极性共价键 c.非极性共价键
(2)B元素比D元素的非金属性强的依据是:。
①两元素组成的化合物中D元素为正价 ②单质的熔沸点的高低
③最高价氧化物对应的水化物的酸性强弱 ④气态氢化物的稳定性
(3)由A、B、D三种元素中的两种可分别形成甲、乙两种粒子,它们均为负一价双原子核的阴离子,且甲含有18个电子,乙含有10个电子,则甲与乙反应的离子方程式为:。
(4)写出C和D两元素的最高价氧化物对应的水化物在稀溶液里相互反应的热化学方程式(已知此反应生成1 mol H2O 时放出的热量为57.3 kJ):。
(5)用A元素的单质与B元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的金属惰性电极浸入KOH溶液,在M极通入A的单质,N极通入B的单质,则M极是该电池的
极;N极的电极反应式为:。
(9分) A、B、C、D、E均为可溶于水的固体,所得的溶液只有E溶液有颜色。取一定量的固体C放在试管中用酒精灯加热,固体的质量会减少。组成这五种物质的离子见下表(各物质所含的离子均不相同)
| 阳离子 |
Na+ Mg2+ Al3+ Ba2+ Fe3+ |
| 阴离子 |
OH- Cl-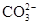 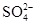 HCO3- HCO3- |
分别取它们的水溶液进行实验,结果如下:
①A溶液分别与其他四种溶液反应,均有沉淀;
②B溶液分别与其他四种溶液反应,也有沉淀;只是当B溶液加入到D溶液中时,有沉淀继续加入B溶液至过量时,沉淀会部分溶解。
(1)据此推断:A;B;C;D;E。(写化学式)
(2)写出下列反应的离子方程式。
①过量的B溶液与C溶液:。
②过量的B溶液与D溶液(已知偏铝酸钡易溶于水):
如图为电解装置,X、Y为电极材料,a为电解质溶液。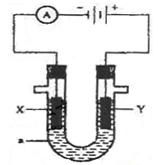
(1)若a为含有酚酞的KCl溶液,X为Fe,Y为石墨,电解一段时间后:
X电极附近可观察到的实验现象是;
写出Y电极的电极反应式。
(2)若要实现Cu +H2SO4=CuSO4+H2↑,
则Y电极材料是;
写出X电极的电极反应式。
(3)若要利用该装置在铁制品表面镀上一层银,则a为 ,反应前两电极的质量相等,反应后电极质量相差2.16g,则该过程理论上通过电流表的电子数为。
(4)若X、Y均为惰性电极,a为NaOH溶液,电解一段时间后,溶液的pH (填“增大”“不变”“减小”),若要使溶液恢复原来的状态,可往溶液中加入 。
请按要求填空:
I.现有:①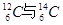 、② O2与O3、③ 正丁烷与异丁烷、④ 金刚石与石墨、⑤ 冰与水、⑥ 乙醇与二甲醚。请用序号填写对应的分类:(1)互为同位素的是( );(2)互为同素异形体的是 ( );(3)互为同分异构体的是( );(4)属于同一化合物的是 ( )
、② O2与O3、③ 正丁烷与异丁烷、④ 金刚石与石墨、⑤ 冰与水、⑥ 乙醇与二甲醚。请用序号填写对应的分类:(1)互为同位素的是( );(2)互为同素异形体的是 ( );(3)互为同分异构体的是( );(4)属于同一化合物的是 ( )
II.现有以下物质:①NaCl晶体②液态(纯)H2SO4③液态的(纯)醋酸④汞(金属)⑤纯蔗糖(C12H22O11)⑥酒精(C2H5OH)⑦熔化的KNO3,请回答下列问题(用序号):
(1)以上物质中能导电的是( ),
(2)以上物质中属于电解质的是( ),
(3)以上物质中属于非电解质的是( ),
(4)以上物质中溶于水后形成的水溶液能导电的是( )。